Замысел
1. Электролиты и неэлектролиты.
2. Теория электролитической диссоциации (ТЭД) С.А.Аррениуса.
3. Механизм электролитической диссоциации электролитов с ионной и ковалентной полярной связью.
4. Степень диссоциации.
5. Кислоты, основания, амфотерные гидроксиды, соли с позиций ТЭД.
6. Значение электролитов для живых организмов.
7. Диссоциация воды. Ионное произведение воды. Водородный показатель. Среды водных растворов электролитов. Индикаторы.
8. Реакции условия и ионного обмена их протекания.
По способности проводить электрический ток в водном растворе либо расплаве все вещества возможно поделить на электролиты и неэлектролиты.
Электролиты – это вещества, растворы либо расплавы которых выполняют электрический ток; в электролитах (кислоты, соли, щелочи) имеются ионные либо полярные ковалентные связи.
Неэлектролиты – это вещества, растворы либо расплавы которых не выполняют электрический ток; в молекулах неэлектролитов (органические вещества, газы, вода) связи ковалентные неполярные либо малополярные.
Для расплавов электропроводности электролитов и объяснения растворов Аррениус в 1887 г. создал теорию электролитической диссоциации, главные положения которой звучат следующим образом.
1. Молекулы электролитов в растворе либо расплаве подвергаются диссоциации (распадаются на ионы). Процесс распада молекул электролитов на ионы в растворе либо расплаве именуется электролитической диссоциацией. Ионы – это частицы, имеющие заряд. Положительно заряженные ионы – катионы, отрицательно заряженные – анионы. Свойства ионов отличаются от особенностей соответствующих нейтральных атомов, что разъясняется различным электронным строением этих частиц.
2. В растворе либо расплаве ионы движутся хаотически. Но при пропускании через раствор либо расплав электрического тока перемещение ионов делается упорядоченным: катионы движутся к катоду (отрицательно заряженному электроду), а анионы – к аноду (положительно заряженному электроду).
3. Диссоциация – обратимый процесс. В один момент с диссоциацией идет ассоциация – процесс образования молекул из ионов.
4. Общая сумма зарядов катионов в растворе либо расплаве равна неспециализированной сумме зарядов анионов и противоположна по символу; раствор в целом электронейтрален.
Основной обстоятельством диссоциации в растворах с полярным растворителем есть сольватация ионов (при водных растворов – гидратация). Диссоциация ионных соединений в водном растворе протекает абсолютно (KCl, LiNO3, Ba(OH)2 и др.). Электролиты с полярной ковалентной связью смогут диссоциировать частично или полностью в зависимости от величины полярности связи (H2SO4, HNO3, HI и др.). В водном растворе образуются гидратированные ионы, но для простоты записи в уравнениях изображаются ионы без молекул воды:
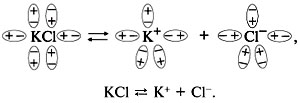
Одни электролиты диссоциируют абсолютно, другие – частично. Для характеристики диссоциации вводится понятие степень электролитической диссоциации . Величина показывает отношение числа диссоциировавших молекул n к числу растворенных молекул N электролита в растворе:
= n/N.
Степень диссоциации возрастает при разбавлении раствора и при увеличении температуры раствора. В зависимости от степени диссоциации электролиты делятся на сильные, средней силы и не сильный. Сильные электролиты полностью диссоциируют в растворе, их степень диссоциации больше 30% и пытается к 100%. К средним электролитам относятся электролиты, степень диссоциации которых колеблется в пределах от 3% до 30%. Степень диссоциации не сильный электролитов меньше 3%. К сильным электролитам относятся соли, сильные кислоты, щелочи. К не сильный – не сильный кислоты, нерастворимые основания, гидроксид аммония, вода.
С позиций теории электролитической диссоциации возможно дать определения веществам различных классов.
Кислоты – это электролиты, образующие при диссоциации анионы и катионы водорода кислотного остатка. Число ступеней диссоциации зависит от основности кислоты, к примеру:
HCl H+ + Cl–,
H2CO3 H+ + HCO3– 2H+ + CO32–.
Основания – это электролиты, диссоциирующие на анионы и катионы металла гидроксигрупп. Число ступеней диссоциации зависит от кислотности основания, к примеру:
NaOH Na+ + 2OH–,
Ca(OH)2 CaOH+ + OH– Ca2+ + 2OH–.
Амфотерные гидроксиды – это не сильный электролиты, каковые при диссоциации образуют как катионы водорода, так и анионы гидроксигруппы, к примеру:
Zn(OH)2 ZnOH+ + OH– Zn2+ + 2OH–,
H2ZnO2 H+ + HZnO2– 2H+ + ZnO22–.
Средние соли – это электролиты, диссоциирующие на анионы и катионы металла кислотного остатка, к примеру:
Na2SO4 2Na+ + SO42–.
Кислые соли – это электролиты, диссоциирующие на сложные анионы и катионы металла, в состав которых входят кислотный остаток и атомы водорода, к примеру:
NaНСO3 Na+ + НСO3–.
Главные соли – это электролиты, диссоциирующие на анионы кислотного остатка и сложные катионы, складывающиеся из атомов металла и гидроксигрупп, к примеру:
Сu(OН)Сl CuОН+ + Сl–.
Комплексные соли – это электролиты, образующие при диссоциации сложные комплексные ионы, каковые достаточно устойчивы в водных растворах, к примеру:
K3[Fe(CN)6] 3K+ + [Fe(CN)6]3–.
Электролиты являются составной частью тканей и жидкостей живых организмов. Для обычного протекания физиологических и химических процессов нужны катионы натрия, калия, кальция, магния, водорода, анионы хлора, сульфат-ионы, гидрокарбонат-ионы, гидроксид-ионы и др. Концентрации этих ионов в организме человека разны. Так, к примеру, концентрации ионов Na и хлора очень велики и каждый день пополняются. Концентрации гидроксид и ионов водорода-ионов малы, но играются громадную роль в жизненных процессах, содействуя обычному функционированию ферментов, обмену веществ, перевариванию пищи и т.д.
Диссоциация воды.
Водородный показатель
Вода есть не сильный амфотерным электролитом. Уравнение диссоциации воды имеет форму:
Н2O Н+ + ОН–
либо
2Н2O Н3О+ + ОН–.
гидроксид и Концентрация протонов-ионов в воде однообразна и образовывает 10–7 моль/л при 25 °С.
Произведение концентраций гидроксид и ионов водорода-ионов именуется ионным произведением воды и при 25 °С образовывает 10–14.
Среду любого водного раствора возможно охарактеризовать концентрацией ионов Н+ либо ОН–. Различают нейтральную, кислую и щелочную среды растворов.
В нейтральной среде раствора:
[H+] = [OH–] = 10–7 моль/л,
в кислой среде раствора:
[H+] [OH–], т.е. [H+] 10–7 моль/л,
в щелочной среде раствора:
[OH–] [H+], т.е. [OH–] 10–7 моль/л.
Для характеристики среды раствора комфортно пользоваться водородным показателем рН (табл. 1, см. с. 14). Водородный показатель – это отрицательный десятичный логарифм концентрации ионов водорода:
рН = –lg[H+].
Таблица 1
Гидролиз солей
Замысел
1. сущность и Определение гидролиза.
2. Гидролиз солей разных типов.
3. Обратимый и необратимый гидролиз.
Слово «гидролиз» (от греч. – разложение и – вода) переводится как разложение водой.
Гидролизом соли именуют сотрудничество ионов соли с водой, приводящее к образованию не сильный электролита. Сущность процесса гидролиза сводится к химическому сотрудничеству катионов либо анионов соли с гидроксид-ионами либо ионами водорода из молекул воды. В следствии этого сотрудничества образуется не сильный электролит. Химическое равновесие процесса диссоциации воды смещается вправо, в сторону образования ионов. Исходя из этого в водном растворе соли появляется избыток свободных ионов Н+ либо ОН–, что и определяет среду раствора соли. При разбавлении раствора либо при увеличении температуры степень гидролиза возрастает.
Любую соль возможно представить как продукт реакции нейтрализации. В зависимости от силы исходных кислоты и основания различают 4 типа солей. Гидролиз солей различных типов протекает по-различному и дает разную среду раствора.
Соль, грамотный слабой кислотой и сильным основанием, подвергается гидролизу по анионному типу, среда раствора – щелочная (рН 7), к примеру:
СН3СООNa + HOH СН3СООH + NaOH,
СН3СОО– + HOH СН3СООH + OH–.
В том случае, в то время, когда соль образована не сильный сильным основанием и многоосновной кислотой, гидролиз по аниону протекает ступенчато и число ступеней гидролиза зависит от основности не сильный кислоты. На первых ступенях гидролиза образуется кислая соль (вместо кислоты) и сильное основание, к примеру:
1-я ступень:
Na2SO3 + HOH NaHSO3 + NaOH,
SO32– + HOH HSO3– + OH–;
2-я ступень:
NaHSO3 + HOH H2SO3 + NaOH,
HSO3– + HOH H2SO3 + OH–.
суммарно:
Na2SO3 + 2HOH H2SO3 + 2NaOH,
SO32– + 2HOH H2SO3 + 2OH–.
Соль, грамотный сильной кислотой и слабым основанием, подвергается гидролизу по катионному типу, среда раствора – кислая (рН 7), к примеру:
NH4Br + HOH NH4OH + HBr,
NH4+ + HOH NH4OH + H+.
В случае, если соль образована не сильный многокислотным сильной кислотой и основанием, катионный гидролиз протекает cтупенчато в зависимости от кислотности не сильный основания. Вместо основания на первых ступенях для того чтобы гидролиза образуется главная соль, к примеру:
1-я ступень:
ZnCl2 + HOH Zn(OH)Cl + HCl,
Zn2+ + HOH Zn(OH)+ + H+;
2-я ступень:
Zn(OH)Cl + HOH Zn(OH)2 + HCl,
Zn(OH)+ + HOH Zn(OH)2 + H+.
суммарно:
ZnCl2 + 2HOH Zn(OH)2 + 2HCl.
Соль, грамотный слабой кислотой и слабым основанием, гидролизуется одновременно и по катиону, и по аниону. Реакция растворов этих солей возможно нейтральной, слабокислой либо слабощелочной, в зависимости от степени диссоциации продуктов гидролиза, к примеру:
(NH4)2CO3 + 2HOH 2NH4OH + H2СО3,
2NH4+ + СО32– + 2НОН 2NH4OH + H2CO3.
Соль, грамотный сильной кислотой и сильным основанием, гидролизу не подвергается, т.к. в ходе реакции не образуется не сильный электролит; среда раствора наряду с этим нейтральная, к примеру:
NaCl + HOH нет реакции.
Для большинства солей гидролиз есть обратимым процессом, но кое-какие соли абсолютно разлагаются водой, т. е. для них гидролиз – необратимый процесс. Необратимому гидролизу подвергаются соли, образованные не сильный нерастворимым либо летучим основанием и не сильный нерастворимой либо летучей кислотой. Такие соли не смогут существовать в водных растворах (Аl2S3, Fe2(СО3)3 и т.п.), к примеру:
Al2S3 + 6HOH = 2Al(OH)3 + 3H2S .
Из-за необратимого гидролиза в реакциях обмена между водными растворами двух солей не всегда образуются новые соли. В таких случаях нужно учитывать реакции гидролиза исходных солей. К примеру, при сотрудничестве водных хлорида сульфида алюминия и растворов калия сперва протекают обменные реакции исходных реагентов с водой, а позже – продуктов реакции между собой. Процесс описывается суммарным уравнением реакции:
3К2S + 2AlCl3 + 6H2O = 2Al(OH)3 + 3H2S + 6KCl.
Замысел
1. Окислительно-восстановительные реакции (ОВР), степень окисления.
2. Процесс окисления, наиболее значимые восстановители.
3. Процесс восстановления, наиболее значимые окислители.
4. Окислительно-восстановительная двойственность.
5. Главные типы ОВР (межмолекулярные, внутримолекулярные, диспропорционирование).
6. Значение ОВР.
7. Способы составления уравнений ОВР (электронный и электронно-ионный баланс).
Все химические реакции по показателю трансформации степеней окисления участвующих в них атомов возможно поделить на два типа: ОВР (протекающие с трансформацией степеней окисления) и не ОВР.
Степень окисления – условный заряд атома в молекуле, вычисленный, исходя из предположения, что в молекуле существуют лишь ионные связи.
П р а в и л а д л я о п р е д е л е н и я с т е п е н е й о к и с л е н и я
Степень окисления атомов несложных веществ равна нулю.
Сумма степеней окисления атомов в сложном веществе (в молекуле) равна нулю.
Степень окисления атомов щелочных металлов +1.
Степень окисления атомов щелочно-земельных металлов +2.
Степень окисления атомов бора, алюминия +3.
Степень окисления атомов водорода +1 (в гидридах щелочных и щелочно-земельных металлов –1).
Степень окисления атомов кислорода –2 (в пероксидах –1).
Каждая ОВР является совокупностью процессов отдачи и присоединения электронов.
Процесс отдачи электронов именуют окислением. Частицы (атомы, молекулы либо ионы), отдающие электроны, именуют восстановителями. В следствии окисления степень окисления восстановителя возрастает. Восстановителями смогут быть частицы в низшей либо промежуточной степенях окисления. Наиболее значимыми восстановителями являются: все металлы в виде несложных веществ, в особенности активные; C, CO, NH3, PH3, CH4, SiH4, H2S и сульфиды, галогеноводороды и галогениды металлов, гидриды металлов, фосфиды и нитриды металлов.
Процесс присоединения электронов именуют восстановлением. Частицы, принимающие электроны, именуют окислителями. В следствии восстановления степень окисления окислителя значительно уменьшается. Окислителями смогут быть частицы в высшей либо промежуточной степенях окисления. Наиболее значимые окислители: простые вещества-неметаллы, владеющие высокой электроотрицательностью (F2, Cl2, O2), перманганат калия, дихроматы и хроматы, нитраты и азотная кислота, концентрированная серная кислота, перхлораты и хлорная кислота.
Вещества, которые содержат частицы в промежуточной степени окисления, смогут выступать как в роли окислителей, так и в роли восстановителей, т.е. проявляютокислительно-восстановительную двойственность.Это сульфиты и сернистая кислота, гипохлориты и хлорноватистая кислота, пероксиды и др.
Различают три типа окислительно-восстановительных реакций.
Межмолекулярные ОВР – восстановитель и окислитель входят в состав разных веществ, к примеру:
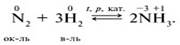
Внутримолекулярные ОВР– восстановитель и окислитель входят в состав одного вещества. Это смогут быть различные элементы, к примеру:
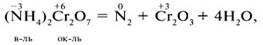
либо один химический элемент в различных степенях окисления, к примеру:
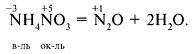
Диспропорционирование (самоокисление-самовосстановление) – восстановителем и окислителем есть одинаковый элемент, находящийся в промежуточной степени окисления, к примеру:
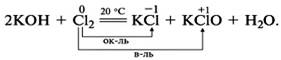
ОВР имеют огромное значение, потому, что большая часть реакций, протекающих в природе, относятся к этому типу (процесс фотосинтеза, горение). Помимо этого, ОВР широко применяются человеком в его практической деятельности (восстановление металлов, синтез аммиака):
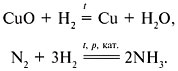
Для составления уравнений ОВР возможно применять способ электронного баланса (электронных схем) либо способ электронно-ионного баланса.
Способ электронного баланса:
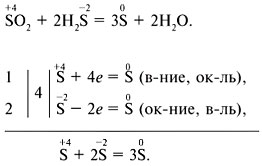
Способ электронно-ионного баланса:
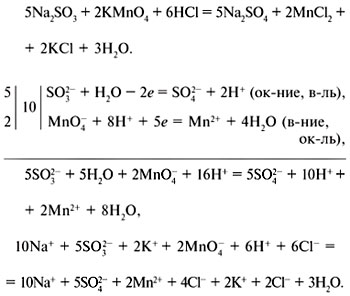
Теория валентных связей
Теория валентных связей первенствовала из квантовомеханических теорий, использованной для приближенного объяснения характера химических связей в комплексных соединениях. В базе ее применения лежала мысль о донорно-акцепторном механизме образования ковалентных связей между лигандом и комплексообразователем. Лиганд считается донорной частицей, талантливой передать несколько электронов акцептору – комплексообразователю, предоставляющему для образования связи свободные квантовые ячейки (ядерные орбитали) собственных энергетических уровней.
Для образования ковалентных связей между комплексообразователем и лигандами нужно, дабы свободные s-, p- либо d-ядерные орбитали комплексообразователя подверглись гибридизации определенного типа. Гибридные орбитали занимают в пространстве определенное положение, причем их число соответствует координационному числу комплексообразователя.
Наряду с этим довольно часто происходит объединение неспаренных электронов комплексообразователя в пары, что разрешает высвободить некое число квантовых ячеек – ядерных орбиталей, каковые после этого участвуют в образовании и гибридизации химических связей.
Неподеленные пары электронов лигандов взаимодействуют с гибридными орбиталями комплексообразователя, и происходит перекрывание соответствующих орбиталей комплексообразователя и лиганда с возникновением в межъядерном пространстве повышенной электронной плотности. Электронные пары комплексообразователя, со своей стороны, взаимодействуют с свободными ядерными орбиталями лиганда, упрочняя сообщение по дативному механизму. Так, химическая сообщение в комплексных соединениях есть простой ковалентной связью, достаточной прочной и энергетически удачной.
Электронные пары, находящиеся на гибридных орбиталях комплексообразователя, стремятся занять в пространстве такое положение, при котором их обоюдное отталкивание будет минимально. Это ведет к тому, что структура комплексных ионов и молекул выясняется в определенной зависимости от типа гибридизации.
Разглядим образование некоторых комплексов с позиций теории валентных связей. В первую очередь напомним, что валентные орбитали атомов комплексообразователей близки по энергии:
E(n-1)d » Ens » Enp » End
| Тип гибридизации | КЧ | Геометрия комплекса | Примеры |
| sp | линейная | [Ag(CN)2]- [Cu(NH3)2]+ | |
| sp2 | треугольная | [HgI3]- | |
| sp3 | тетраэдр | [Be(OH)4]2- [MnCl4]2- [Zn(NH3)4]2+ | |
| dsp2 | квадрат | [Ni(CN)4]2- [PtCl4]2- [Pt(NH3)2Cl2]0 | |
| sp3d(z2) | тригональная бипирамида | [Fe(CO)5] | |
| sp3d(x2-y2) | квадратная пирамида | [MnCl5]3- [Ni(CN)5]3- | |
| sp3d2, d2sp3 | октаэдр | [Al(H2O)6]3+ [SnCl6]2- [Co(NH3)6]3+ [Fe(CN)6]3- | |
| sp3d3 | пентагональная бипирамида | [V(CN)7]4- [ZrF7]3- |
К примеру, катион [Zn(NH3)4]2+ включает комплексообразователь цинк(II). Электронная оболочка этого условного иона имеет формулу [Ar] 3d10 4s0 4p0 и возможно условно изображена так:
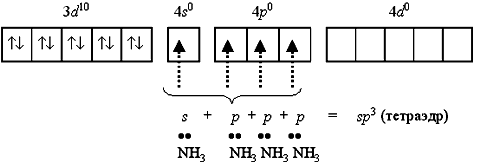
Свободные 4s- и 4p-орбитали атома цинка(II) образуют четыре sp3-гибридные орбитали, ориентированные к вершинам тетраэдра.
Любая молекула аммиака имеет неподеленную несколько электронов у атома азота. Орбитали атомов азота, которые содержат неподеленные пары электронов, перекрываются с sp3-гибридными орбиталями цинка(II), образуя тетраэдрический комплексный катион тетраамминцинка(II) [Zn(NH3)4]2+:
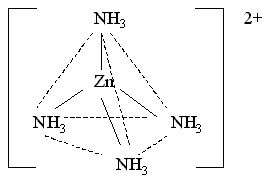
Потому, что в ионе [Zn(NH3)4]2+ нет неспаренных электронов, то он проявляет диамагнитные особенности.
Тетрахлороманганат(II)-ион [MnCl4]2- содержит пять неспаренных электронов на 3d-орбитали и свободные 4s- и 4p-орбитали. Свободные орбитали образуют sp3-гибридные орбитали, каковые перекрываются с p-ядерными орбиталями хлорид-ионов:
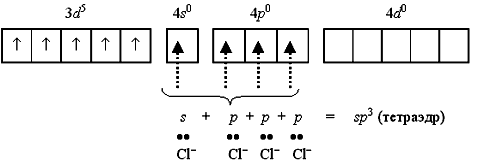
Полученный так тетраэдрический ион [MnCl4]2- есть парамагнитным, поскольку содержит пять неспаренных электронов.
Замысел
1. Электролиты и неэлектролиты.
2. Теория электролитической диссоциации (ТЭД) С.А.Аррениуса.
3. Механизм электролитической диссоциации электролитов с ионной и ковалентной полярной связью.
4. Степень диссоциации.
5. Кислоты, основания, амфотерные гидроксиды, соли с позиций ТЭД.
6. Значение электролитов для живых организмов.
7. Диссоциация воды. Ионное произведение воды. Водородный показатель. Среды водных растворов электролитов. Индикаторы.
8. Реакции условия и ионного обмена их протекания.
По способности проводить электрический ток в водном растворе либо расплаве все вещества возможно поделить на электролиты и неэлектролиты.
Электролиты – это вещества, растворы либо расплавы которых выполняют электрический ток; в электролитах (кислоты, соли, щелочи) имеются ионные либо полярные ковалентные связи.
Неэлектролиты – это вещества, растворы либо расплавы которых не выполняют электрический ток; в молекулах неэлектролитов (органические вещества, газы, вода) связи ковалентные неполярные либо малополярные.
Для расплавов электропроводности электролитов и объяснения растворов Аррениус в 1887 г. создал теорию электролитической диссоциации, главные положения которой звучат следующим образом.
1. Молекулы электролитов в растворе либо расплаве подвергаются диссоциации (распадаются на ионы). Процесс распада молекул электролитов на ионы в растворе либо расплаве именуется электролитической диссоциацией. Ионы – это частицы, имеющие заряд. Положительно заряженные ионы – катионы, отрицательно заряженные – анионы. Свойства ионов отличаются от особенностей соответствующих нейтральных атомов, что разъясняется различным электронным строением этих частиц.
2. В растворе либо расплаве ионы движутся хаотически. Но при пропускании через раствор либо расплав электрического тока перемещение ионов делается упорядоченным: катионы движутся к катоду (отрицательно заряженному электроду), а анионы – к аноду (положительно заряженному электроду).
3. Диссоциация – обратимый процесс. В один момент с диссоциацией идет ассоциация – процесс образования молекул из ионов.
4. Общая сумма зарядов катионов в растворе либо расплаве равна неспециализированной сумме зарядов анионов и противоположна по символу; раствор в целом электронейтрален.
Основной обстоятельством диссоциации в растворах с полярным растворителем есть сольватация ионов (при водных растворов – гидратация). Диссоциация ионных соединений в водном растворе протекает абсолютно (KCl, LiNO3, Ba(OH)2 и др.). Электролиты с полярной ковалентной связью смогут диссоциировать частично или полностью в зависимости от величины полярности связи (H2SO4, HNO3, HI и др.). В водном растворе образуются гидратированные ионы, но для простоты записи в уравнениях изображаются ионы без молекул воды:

Одни электролиты диссоциируют абсолютно, другие – частично. Для характеристики диссоциации вводится понятие степень электролитической диссоциации . Величина показывает отношение числа диссоциировавших молекул n к числу растворенных молекул N электролита в растворе:
= n/N.
Степень диссоциации возрастает при разбавлении раствора и при увеличении температуры раствора. В зависимости от степени диссоциации электролиты делятся на сильные, средней силы и не сильный. Сильные электролиты полностью диссоциируют в растворе, их степень диссоциации больше 30% и пытается к 100%. К средним электролитам относятся электролиты, степень диссоциации которых колеблется в пределах от 3% до 30%. Степень диссоциации не сильный электролитов меньше 3%. К сильным электролитам относятся соли, сильные кислоты, щелочи. К не сильный – не сильный кислоты, нерастворимые основания, гидроксид аммония, вода.
С позиций теории электролитической диссоциации возможно дать определения веществам различных классов.
Кислоты – это электролиты, образующие при диссоциации анионы и катионы водорода кислотного остатка. Число ступеней диссоциации зависит от основности кислоты, к примеру:
HCl H+ + Cl–,
H2CO3 H+ + HCO3– 2H+ + CO32–.
Основания – это электролиты, диссоциирующие на анионы и катионы металла гидроксигрупп. Число ступеней диссоциации зависит от кислотности основания, к примеру:
NaOH Na+ + 2OH–,
Ca(OH)2 CaOH+ + OH– Ca2+ + 2OH–.
Амфотерные гидроксиды – это не сильный электролиты, каковые при диссоциации образуют как катионы водорода, так и анионы гидроксигруппы, к примеру:
Zn(OH)2 ZnOH+ + OH– Zn2+ + 2OH–,
H2ZnO2 H+ + HZnO2– 2H+ + ZnO22–.
Средние соли – это электролиты, диссоциирующие на анионы и катионы металла кислотного остатка, к примеру:
Na2SO4 2Na+ + SO42–.
Кислые соли – это электролиты, диссоциирующие на сложные анионы и катионы металла, в состав которых входят кислотный остаток и атомы водорода, к примеру:
NaНСO3 Na+ + НСO3–.
Главные соли – это электролиты, диссоциирующие на анионы кислотного остатка и сложные катионы, складывающиеся из атомов металла и гидроксигрупп, к примеру:
Сu(OН)Сl CuОН+ + Сl–.
Комплексные соли – это электролиты, образующие при диссоциации сложные комплексные ионы, каковые достаточно устойчивы в водных растворах, к примеру:
K3[Fe(CN)6] 3K+ + [Fe(CN)6]3–.
Электролиты являются составной частью тканей и жидкостей живых организмов. Для обычного протекания физиологических и химических процессов нужны катионы натрия, калия, кальция, магния, водорода, анионы хлора, сульфат-ионы, гидрокарбонат-ионы, гидроксид-ионы и др. Концентрации этих ионов в организме человека разны. Так, к примеру, концентрации ионов Na и хлора очень велики и каждый день пополняются. Концентрации гидроксид и ионов водорода-ионов малы, но играются громадную роль в жизненных процессах, содействуя обычному функционированию ферментов, обмену веществ, перевариванию пищи и т.д.
Диссоциация воды.
Водородный показатель
Вода есть не сильный амфотерным электролитом. Уравнение диссоциации воды имеет форму:
Н2O Н+ + ОН–
либо
2Н2O Н3О+ + ОН–.
гидроксид и Концентрация протонов-ионов в воде однообразна и образовывает 10–7 моль/л при 25 °С.
Произведение концентраций гидроксид и ионов водорода-ионов именуется ионным произведением воды и при 25 °С образовывает 10–14.
Среду любого водного раствора возможно охарактеризовать концентрацией ионов Н+ либо ОН–. Различают нейтральную, кислую и щелочную среды растворов.
В нейтральной среде раствора:
[H+] = [OH–] = 10–7 моль/л,
в кислой среде раствора:
[H+] [OH–], т.е. [H+] 10–7 моль/л,
в щелочной среде раствора:
[OH–] [H+], т.е. [OH–] 10–7 моль/л.
Для характеристики среды раствора комфортно пользоваться водородным показателем рН (табл. 1, см. с. 14). Водородный показатель – это отрицательный десятичный логарифм концентрации ионов водорода:
рН = –lg[H+].
Таблица 1
Водородный показатель для разных сред растворов
| Черта раствора | Среда раствора | ||
| кислая | нейтральная | щелочная | |
| Kонцентрация ионов Н+ (моль/л) | [H+] 10–7 | [H+] = [OH–] = 10–7 | [H+] 10–7 |
| Водородный показатель (направляться) | pH 7 | pH = 7 | pH 7 |
В кислой среде раствора рН 7. Чем меньше рН, тем больше кислотность раствора. При значениях рН 7 говорят о щелочности раствора.Существуют разные способы определения рН раствора. как следует темперамент среды раствора определяют посредством индикаторов. Индикаторы – вещества, каковые обратимо изменяют собственный цвет в зависимости от среды раствора. На практике значительно чаще используют лакмус, метиловый оранжевый, универсальный индикатор и фенолфталеин (табл. 2).
Таблица 2