СпН2п (СООН)2 — неспециализированная формула предельных двухосновных кислот.
Ниже приводятся наиболее значимые из них:
НООС — СООН щавелевая, этандиовая кислота
НООС — СН2 — СООН малоновая, пропандиовая кислота
НООС — СН2 — СН2 — СООН янтарная, бутандиовая кислота
НООС — СН2 — СН2 — СН? — СООН глутаровая, пентандиовая кислота
НООС — С1Ь — СН2 — СН2 — СН2 — СООН адипиновая, гександиовая кислота
Самые простые ненасыщенные двухосновные, кислоты — фумаровая и малеиновая — имеют одну и ту же структурную формулу НООС—СН=СН—СООН, но различную пространственную конфигурацию. Фумаровая -транс-, а малеиновая — цис-изомеры.

Обе кислоты получаются при нагревании яблочной кислоты:
НООС -? СН2 ? СНОН ? СООН t° Н20 +НООС ? СН = СН ? СООН
В зависимости от режима нагревания получается тот либо второй изомер. Фумаровая кислота встречается в природе, она — одна из кислот цикла Кребса. Малеиновая кислота (правильнее ее ангидрид) купила широкое использование в производстве полиэфирных смол, сополимеров и др. Приобретают ее много окислением бензола, нафталина. Обе кислоты владеют особенностями непредельных углеводородов и двухосновных кислот.
Неспециализированные способы получения предельных двухосновных кислотаналогичны методам получения одноосновных кислот, к примеру:
1) окисление двупервичных гликолей:
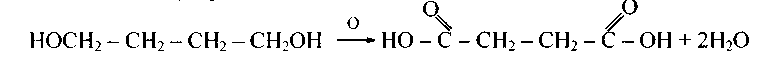
2) гидролиз (омыление) динитрилов:
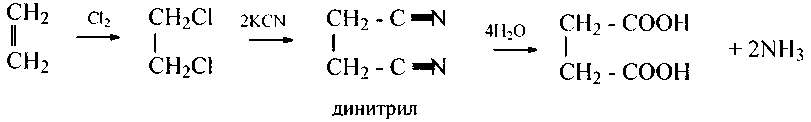
3) синтез через магнийорганические соединения:
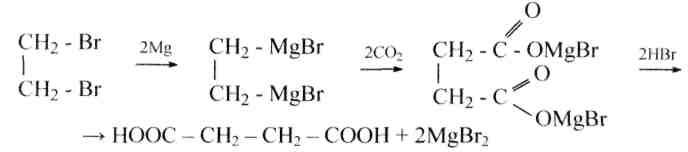
128. Напишите структурные формулы следующих соединений: а) диэтиловый эфир малоновой кислоты (малоновый эфир); б) метилянтарная кислота; в) метилмалоновая кислота; г) хлор-малоновая кислота; д) оксиянтарная кислота; е) натриймалоновый эфир; ж) диметилмалоновый эфир; з) ?-аминоглутаровая кислота; и) ?-кетоглутаровая кислота; к) этилмалоновая кислота; л) малеиновокислый натрий.
129. Назовите кислоты, получающиеся при окислении следующих гликолей:
а) пропандиол-1,3; б) 2-метилпропандиол-1,3; в) бутандиол-1,4; г) этиленгликоль; д) пентандиол-1,5; е) 2-метилпентандиол-1,5; ж) 2-метилбутандиол-1,4; з) 2-оксиметилбутанол-1.
130.Напишите уравнения реакций омыления нитрилов, взятых при сотрудничестве цианистого калия со следующими дигалогеналканами и назовите полученные кислоты:
а) 1,2-дибромэтан; б) хлористый метилен; г) 2,3-дибромбутан; д) монохлоруксусная кислота; е) 1,1-дибромпропан; ж) 1,2-дибромпропан; з) 1,1-дибром-2-метилпропан.
131.Напишите схему последовательного сотрудничества следующих соединений с соляной кислотой и углекислым газом:
а) 1,2-димагнийхлорэтан; б) 1,2-димагнийбромпропан; в) 1,4- димагнийхлорбутан; г) 1,2-димагнийхлорпентан; д) димагнийбромметан; е) 1,3-димагнийбром-2-метилпропан; ж) 1,2-димагнийбром-2-метилпропан; з) 1,3-димагнийбромбутан.
Химические особенности
Двухосновные кислоты более сильные, чем одноосновные. Они способны давать все производные кислот по одному либо двум карбоксилам: соли нейтральные и кислые, полные и неполные амиды и сложные эфиры. Щавелевая и малоновая кислоты не образуют ангидридов, остальные все способны давать ангидриды, к примеру:
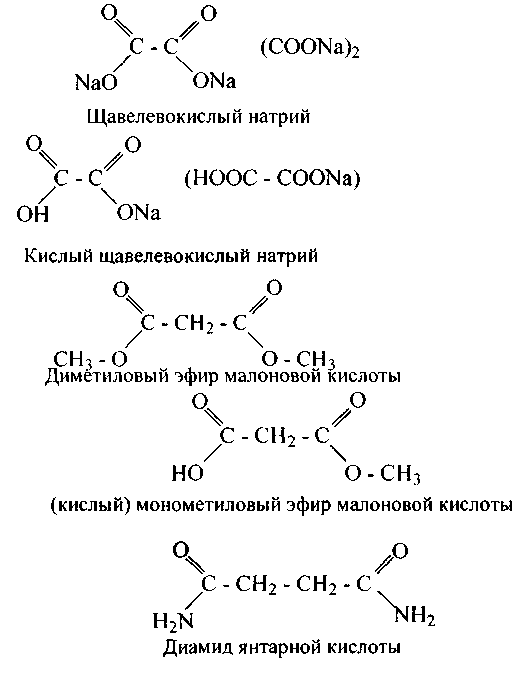
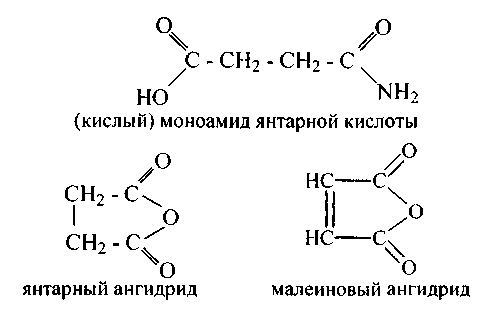
Фумаровая кислота не дает циклического ангидрида, а малеиновая легко его образует, поскольку оба карбоксила расположены по одну сторону двойной связи.
132. Напишите уравнения реакций между следующими веществами и назовите полученные соединения:
а) щавелевая кислота + СаСl2; б) малеиновая кислота + этиловый спирт; в) янтарная кислота (нагревание, дегидратация); г) глутаровая кислота + NaOH; д) адипиновая кислота + СаСO3; е) полный метиловый эфир янтарной кислоты + NaOH; ж) малоновый эфир + этилат натрия; з) натриймалоновый эфир + хлористый этил.
Г. АРОМАТИЧЕСКИЕ КИСЛОТЫ
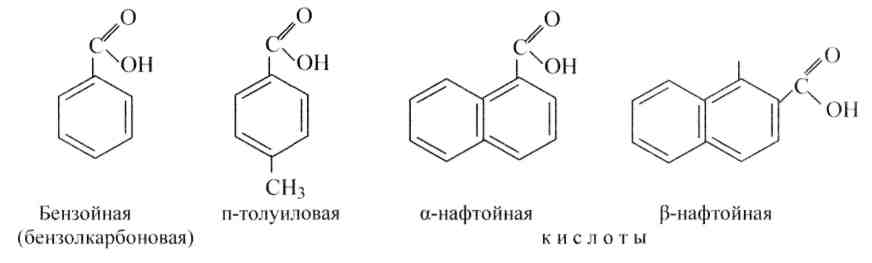
В случае, если карбоксильная несколько кислоты соединена с углеродом бензольного (либо другого ароматического) ядра, то такие кислоты именуются ароматическими, к примеру:
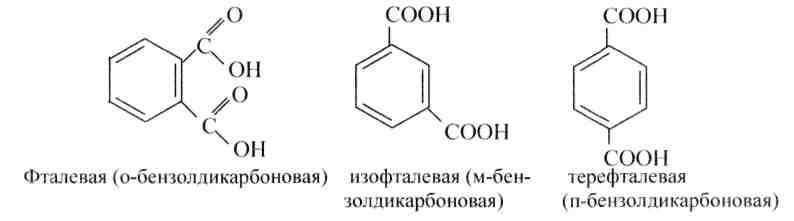
Двухосновные ароматические кислоты бензольного последовательности представлены тремя изомерами:
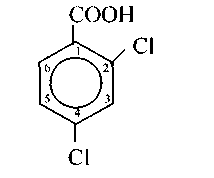
В случае, если количество помощников бензольного ядра больше двух, то номеруют углероды бензольного ядра, начиная с углерода, имеющего карбоксил, к примеру 2,4-дихлорбензойная кислота.
133.Напишите структурные формулы следующих соединений:
а) 3,5-динитробензойная кислота; б) п-хлорбензойная кислота; в) 2,4,5-трихлорбензойиая кислота; г) фенилуксусная кислота; д) о-фталевая кислота; е) 2,4-дихлорфеноксиуксусная кислота (препарат 2,4-Д); ж) 2-метил-4-хлорфеноксиуксусная кислота (препарат 2м-4х); з) фталевый ангидрид; и) ?-нафтилуксусная кислота; к) ?-хлор-?-нафтилуксусная кислота.
Методы получения
1) Ароматические кислоты приобретают окислением ароматических углеводородов, спиртов, альдегидов и кетонов, как мы знаем, ароматическое ядро устойчиво к окислению.
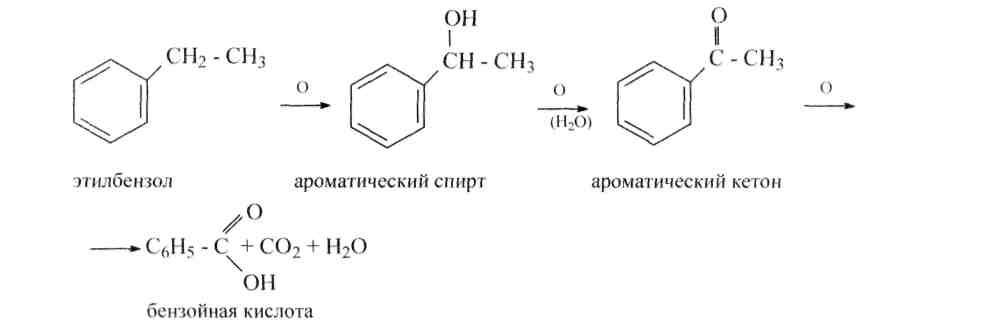
134.Назовите кислоты, образующиеся при окислении следующих соединений: а) толуол; б) о-ксилол; в) п-метилбензальдегид; г) бензиловый спирт; д) п-нитротолуол; е) 2,4,6-тринитротолуол. ж) п-ксилол; з) симметричный триметилбензол; и) м-ксилол; к) о-нитротолуол.
2) Получение ароматических кислот через нитрилы и магнийорганические соединения подобно получению предельных одноосновных кислот.
135.Напишите уравнения реакций сотрудничества цианистого калия со следующими соединениями. Назовите, какие конкретно кислоты получаются при омылении продуктов реакции:
а) бензилхлорид; б) фенилбромид; в) ?-хлорнафталин; г) о-бромтолуол; д) м-нитрофенилхлорид; е) п-толилхлорид; ж) 3-бромнафталин; з) о-толилхлорметан.
136.Назовите кислоты, получающиеся при гидролизе продуктов реакции СО2 со следующими соединениями:
а) п-метилфенилмагнийбромид; б) м-нитробензилмагнийхлорид; в) ?-нафтилмагнийхлорид; г) ?-нафтилмагнийбромид: д) о-толилмагнийбромид; е) п-метилбензилмагнийбромид; ж) 2-нитро-1-магнийбромбензол (2-нитрофенилмагнийбромид); з) 3-направляться-4-метил-1-магнийбромбензол (3-нитро-4-метилфеннлмагнийбромид).
Химические особенности
Ароматические кислоты пара более сильные, чем предельные кислоты жирного последовательности, в этом отражается влияние ароматического, ядра на карбоксильную группу. Ароматические кислоты проявляют все неспециализированные особенности карбоновых кислот.
Иначе, карбоксильная несколько воздействует на направление реакций замещения водородов бензольного ядра.
137.Назовите соединения, образующееся в следующих реакциях:
а) бензойная кислота + NaOH; б) бензойная кислота + метанол; в) бензойная кислота + Сl2; г) ?-хлорбензойная кислота + HN03; д) фталевая кислота + РС15; е) фталевая кислота + аммиак; ж) коричная кислота + 1% р-р КМn04 (около 0°С, щелочная среда); з) ?-фенилакриловая кислота + НВr; и) бензойная кислота + РС15; к) бензоилхлорид + Na202; л) бензоилхлорид + изопропиловый спирт; м) бензоилхлорид + бензойнокислый натрий.
XIII. ЖИРЫ и СЛОЖНЫЕ ЭФИРЫ
А. СЛОЖНЫЕ ЭФИРЫ 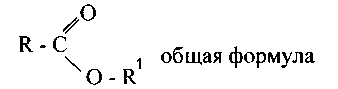
Сложные эфиры — это продукты замещения водорода карбоксила кислот на углеводородные радикалы. Заглавия их составляются из названий кислоты и углеводородного радикала:
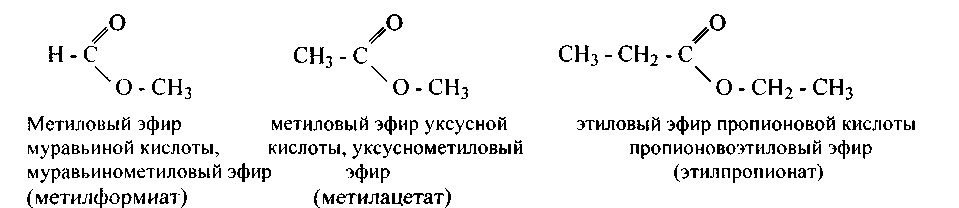
Заглавия сложных эфиров возможно кроме этого составлять подобно заглавиям солей. Соли муравьиной кислоты именуются формиатами,уксусной — ацетатами,пропионовой -пропионатами,масляной — бутиратами,щавелевой — оксалатами,лимонной — цитратамии т, д.
| Сложные эфиры неорганических кислородных кислот имеют подобные заглавия, к примеру: |
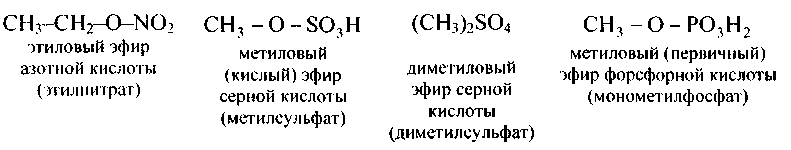
|
Соответственно именуют и сложные эфиры:
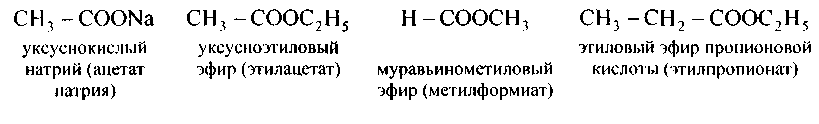
138.Напишите структурные формулы следующих сложных эфиров и дайте им другие заглавия:
а) этилацетат; б) метилбутират; в) изопропилформиат; г) пропилпропионат; д) изопропил-изобутират; е) этилвалерат; ж) пропилнитрат; з) масляноэтиловый эфир; и) этиловый эфир изомасляной кислоты; к) диэтилсульфат; л) диэтилфосфат; м) циклогексилфосфат.
Методы получения
1)Строение сложных эфиров доказывается их получением при действии алкилгалогенидов на соли кислот,либо 2) при действии алкоголятов спиртов на галогенангидриды кислот:
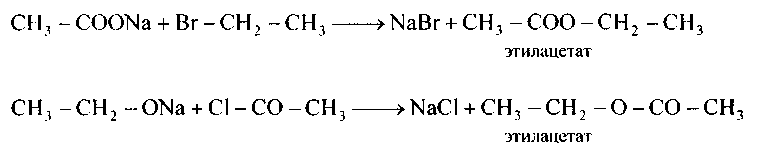
139.Напишите уравнения реакций получения следующих сложных эфиров а) из солей карбоновых кислот и алкилгалогенидов; б) из галогенангидридов алкоголятов и кислот соответствующих спиртов:
а) изопропилбутират; б) масляноэтиловый эфир; в) пропилацетат; г) уксусно-втор-бутиловый эфир; л) этилвалерат; е) пропионовоизобутиловый эфир; ж) изопентилформиат (одним методом, потому что галогенангидрид и ангидрид метановой кислоты неустойчивы, не взяты); з) изомасляноэтиловый эфир.
3. Сложные эфиры приобретают реакцией этерификации кислот первичными и вторичными спиртами 4) ацилированием спиртов и фенолов галогенангидридами и ангидридами кислот. Так, например, приобретают сложные эфиры третичных спиртов и фенолов:
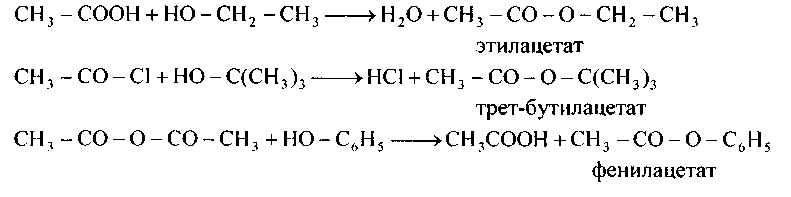
140.Приведите уравнения и механизм реакций получения сложных эфиров, приведенных в упражнении 139.а) этерификацией карбоновых кислот соответствующими спиртами; б) ацилированием спиртов ангидридами; в) галогенан гидридам и кислот.
Промышленное значение имеет 5) присоединение карбоновых кислот к алкенам (в присутствии трехфтористого бора) и 6) ацетилену (при 200°С в присутствии цинка и солей кадмия):
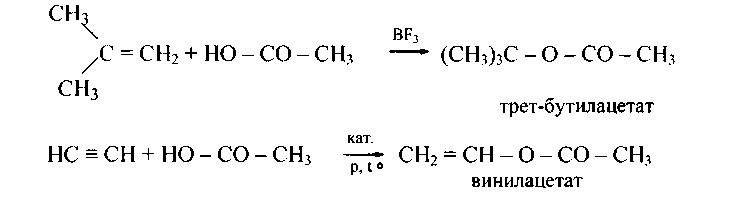
141.Приведите уравнения и механизм реакций ацетилирования а) хлористым ацетилом; б) уксусным ангидридом следующих соединений: а) триметилкарбинол; б) о-крезол; в) метилэтилкарбинол; г) м-крезол; д) метилдиэтилкарбинол; е) п-крезол; ж) 2-метилбутанол-2; з) фенол.
Химические особенности
1. Реакция гидролизапротекает как в кислой , так и в щелочной среде:
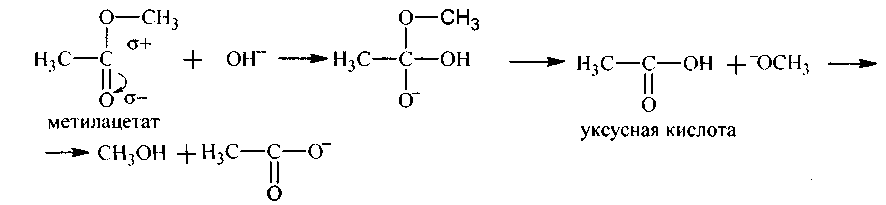
142.Напишите уравнения (и механизм) гидролиза сложных эфиров, приведенных в упражнении 139в кислой и щелочной средах.
2. Реакция алкоголиза сложных эфиров(переэтерификация) протекает при нагревании их с спиртами в присутствии минеральной кислоты либо алкоголята (щелочная среда). Реакция обратимая, направление зависит от количества забранного других условий и спирта:
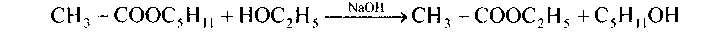
3. Аммонолиз сложных эфировпротекает довольно часто кроме того на холоду с образованием спиртов и амидов кислот:
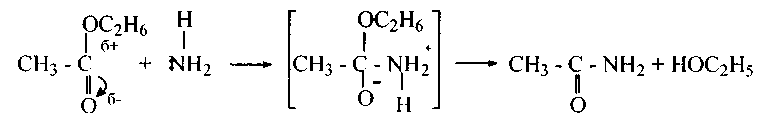
Механизм реакций гидролиза, аммонолиза и алкоголиза сложных эфиров подобный.
143.Приведите уравнения и механизм следующих реакций и назовите полученные соединения:
а) трет-пентил-2-метилпропаноат + 2-метилпропанол-1;
б) 2-метилбутилпропаноат + 25%-ный раствор аммиака;
в) 3-метилбутилпропаноат + 2-метилпропанол-1;
г) изобутил-2-метилпропаноат + 25%-ный раствор аммиака;
д) изопентилпропаноат + пропанол-1;
е) 1-метилбутилпропаноат + 25%-ный раствор аммиака;
ж) трет-бутил-2-метилпропаноат + этиловый спирт;
з) втор-бутил-2-метилпропаноат + 25%-ный раствор аммиака.
4. Сложные эфиры реагируют с алкилмагнийгалогенидамиподобно кетонам и альдегидам. Наряду с этим отщепляется алкоголят магнийгалогенида и образуется кетон:
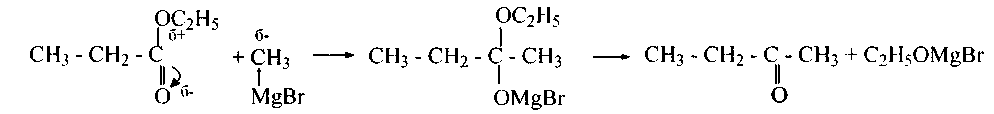
Реакцию возможно остановить на данной стадии, в случае, если вести процесс при недостатке и сильном охлаждении алкилмагнийгалогенида. В противном случае кетон реагирует потом до третичного спирта:
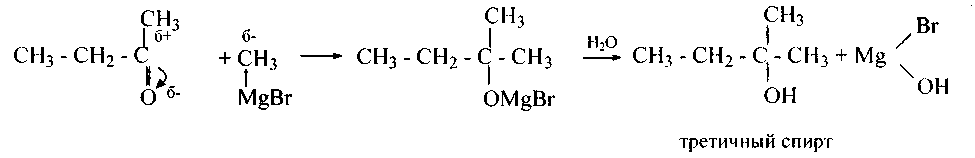
144.Напишите уравнения (и механизм) реакций этилмагнийиодида со следующими сложными эфирами и назовите полученные третичные спирты и кетоны: а) этилпропаноат; б) пропилэтаноат; в) изопропилбутаноат; г) изопропилэтаноат; д) метил-2-метилпропаноат; е) этил-2-метилпропаноат; ж) пропилбутаноат; з) бутилпропаноат.
5. Восстановление сложных эфировпротекает легче, чем самих кислот. Получается первичный спирт, соответствующий кислоте сложного эфира. Восстановителями являются литийалюминийгидрид, натрий в кипящем спирте, водород в присутствии скелетного никелевого либо бронзово-хромового катализаторов:
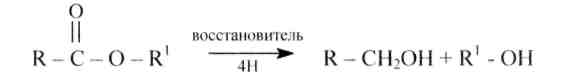
145.Напишите уравнения реакций восстановления сложных эфиров, приведенных в упражнении 144,а) литийалюминийгидридом; б) натрием в изопентиловом спирте; в) водородом в присутствии катализатора.
6. Сложные, эфиры устойчивы к действию окислителей.Благодаря этого для защиты спиртовых либо фенольных групп в реакциях окисления эти группы предварительно этерифицируют, а по окончании окисления гидролизуют.
Б. ЖИРЫ
Основной составной частью растительных и животных жиров являются сложные эфиры глицерина и высших жирных кислот — триглицериды, которые содержат остатки пальмитиновой, стеариновой, олеиновой, линолевой, линоленовой и других, кислот. В общем виде триглицериды имеют строение:
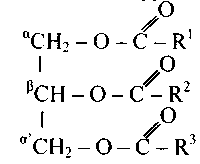
где направляться1, R2, R3 — радикалы жирных кислот, ?, ?, ?1 — обозначения углеродных атомов глицерина, к каким прикреплены ковалентной связью ацилокси-группы (RCOO).
В случае, если остатки R1 , R2 , R3 являются остатками одной и той же кислоты, то триглицерид именуется несложным, в другом случае — смешанным.
Большая часть жиров содержат две либо три главные кислоты и другие кислоты в меньшем количестве. Все кислоты распределены так, что образуется много смешанных триглицеридов, поэтому ?-углеродные атомы триглицеридов являются асимметрическими, к примеру,

Жиры владеют всеми особенностями сложных эфиров, но фактически употребляются реакции гидролиза (либо омыления) — для изготовление мыла, гидрирования — для изготовление гидрожира, маргарина, саломаса, окисления по полимеризации и двойным связям кислот (высыхание масел при крашении масляными красками).
146.Напишите уравнения следующих реакций и назовите полученные триглицериды (укажите в них асимметрические атомы углерода звездочкой):
а) ?-олео-?-стеарат глицерина + С 17Н 31 СООН
б) ?-стеарат глицерина + 2С1 7Н33СООН
в) ?, ?-дистеарат глицерина + С17Н33 СООН
г) ?-стеарат глицерина + 2С17Н35СООН
д) ?-олеат глицерина + 2С17Н33СООН
е) ?, ?-диолеат глицерина + С17Н 35СООН
ж) ?-линоло-?-стеарат глицерина + С17Н33СООН
з) ?-линоло-?-пальмитат глицерина + С17Н33СООН
и) ?-олео-?-пальмитат глицерина + С17Н29СООН
к) ?-линолено-?-олеат глицерина + С17Н31СООН
XIV. АМИНЫ
Амины являются продуктами замещения водородов аммиака на углеводородные радикалы. В зависимости от того, сколько атомов водорода замещено на радикалы, различают амины первичные R—NH2, вторичные R2NH и третичные R3N.
Тут понятия первичный, вторичный и третичный связаны не с характером углеродного атома, а со степенью замещения водородов при атоме азота аммиака.
номенклатура и Изомерия
Изомерия аминов зависит от местонахождения аминогруппы в углеродной цепи и от строения и количества радикалов, которые связаны с атомом азота.
Дабы назвать амин по рациональной номенклатуре, сперва перечисляют заглавия радикалов, а после этого додают слово «амин», к примеру, СН3—NH2 метиламин, СН3—NH—СН2—СН3 метилэтиламин и т.д. Дабы назвать по систематической номенклатуре, нумеруют углеродные атомы большего радикала, к примеру,
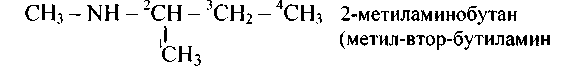
147.Напишите структурные формулы следующих соединений и дайте им другие заглавия (где это допустимо):
а) изопропиламин; б) метилэтиламин; в) 2-аминобутан; г) диметилпропиламин; д) триметиламин; е) изобутиламин; ж) 1,2-диаминоэтан; з) 1,4-диаминобутан (путресцин); и) пентаметилендиамин (кадаверин); к) фениламин; л) N-диметиланилин; м) о-этиланилин; н) о-толуидин; о) ?-нафтиламин; п) 2-нитро-4-метиланилин; р) 2,4,6-триброманилин.
148.Напишите структурные формулы и назовите все изомеры аминов состава:
а) C3H9N (4 изомера);
б) C4H11N (7 изомеров).
Методы получения
1. Нитросоединения восстанавливаются водородомв присутствии катализаторов Pt, Pd, Ni либо вторыми методами с образованием первичных аминов (реакция Н. Н. Зинина)1:
R-NO2 + ЗН2 R-NH2+2H20
149.Назовите амины, образующиеся при восстановлении следующих нитросоединений:
а) 3-нитропентан; б) 1,4-динитробутан; в) 2,4-диметил-З-нитропентан; г) п-нитротолуол; д) 3-хлорнитробензол; е) п-нитроэтилбензол; ж) нитрофенилметан; з) ?- и ?-нитронафталины.
2. Оксимы, фенилгидразоны альдегидов и кетонов, амиды и нитрилы карбоновых кислот, изонитрилыпри восстановлении водородом в момент выделения, натрием в спирте либо молекулярным водородом (кат-ры Ni, Pd, Pt) дают амины:
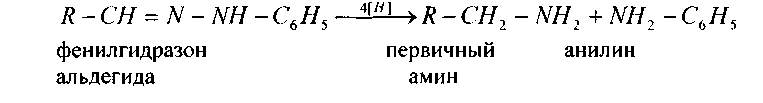
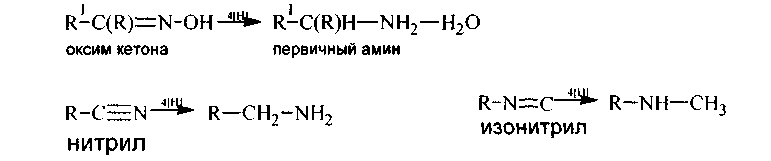
Амиды кислот легко восстанавливаются и литийалюминийгидридом:
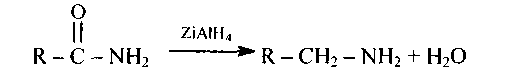
150.Назовите амины, получающиеся при восстановлении оксимов и фенилгидразонов следующих альдегидов и кетонов: а) ацетон; б) этанал; в) бутанон-2; г) пропанал; д) 4-метилпентанон-2; е) 2-метилпропанал-1; ж) З-метилбутанон-2; з) 2-метилбутанал-1.
151.Назовите амины, получающиеся при восстановлении соединений: а) нитрил уксусной кислоты; б) нитрил бензойной кислоты; в) динитрил янтарной кислоты; г) фенилизонитрил; д) нитрил о-толуиловой кислоты; е) этилизонитрил; ж) п-толилцианид; з) изопроиилцианид; и) изобутилизонитрил; к) о-толилизонитрил.
3. Расщепление амидов кислот гипохлоритами и гипобромитамив щелочной среде (перегруппировка Гофмана) ведет к первичным аминам.
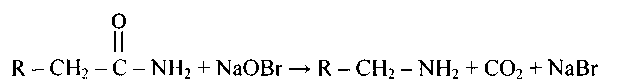 .
.
152.Напишите уравнения реакций получения аминов из амидов карбоновых кислот, приведенных в упражнении 120,а) восстановлением литийалюминийгидридом; б) расщеплением по Гофману.
4. Универсальным методом получения аминов есть реакция Гофмана.Действием аммиака на галогенопроизводные углеводородов приобретают смесь солей разных аминов, поскольку образующиеся на протяжении реакции амины (благодаря частичному разложению солей аммиаком) вступают со своей стороны в реакцию с галогеналканами. Реакция идет в пара стадий:
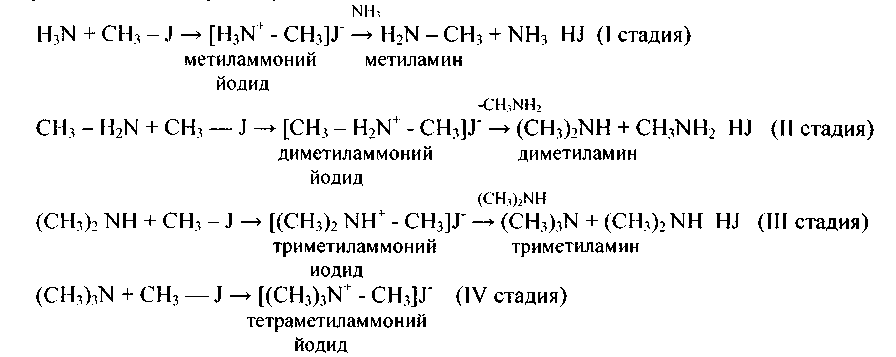
Эта смесь легко разделяется. При перегонке с паром из щелочной среды отгоняются первичные, вторичные и третичные амины. В колбе остается сполна замещенное либо четвертичное аммониевое основание (CH3)4NOH. Продукты отгона с паром разделяют, пользуясь их разной реакционной свойством по отношению к некоторым сульфохлоридам.
153.Напишите уравнения реакций сотрудничества следующих веществ и назовите продукты: а) метиламин + этилхлорид; б) 2-хлорпропан + аммиак; в) изобутилхлорид + аммиак; г) 2-метил-3-аминопропан + метилйодид; д диметиламин + этилйодид; е) метилдиэтиламин + пропилхлорид; ж) бензилхлорид + аммиак; з) орто-толилбромид + аммиак.
Химические особенности аминов
1. Амины выявляют громадное сходство с аммиаком.Так, водные растворы их имеют очевидно главный темперамент благодаря образования сполна ионизированных алкилзамещенных гидроксидов аммония, к примеру:
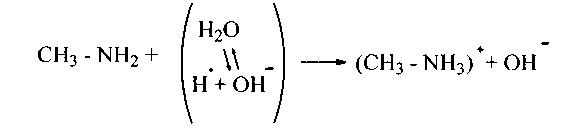
Фундаментальные особенности аминов обусловлены свойством трехвалентного атома азота присоединять протон Н+ к свободной паре валентных (внешних) электронов с образованием катиона аммония (координационная сообщение):
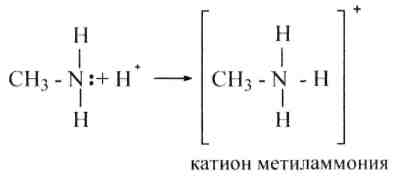
Фундаментальные особенности аминов жирного последовательности выше, чем у аммиака, потому, что индуктивный эффект алкилов (электронодонорные свойства) увеличивает электронную плотность на атоме азота, что делает более активной свободную несколько валентных электронов атома азота. По данной же причине фундаментальные особенности усиливаются в последовательности от первичного амина до четвертичного, другими словами по мере замещения водородов катиона аммония на алкил.
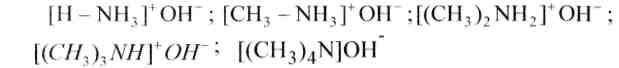
Так, самым сильным основанием в этом последовательности есть гидрооксид тетраметиламмония.
.2. Амины с кислотами дают алкилзамещенные соли аммония(либо арилзамещенные);
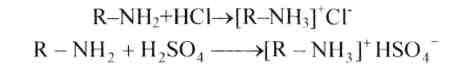
3. Первичные амины возможно ацилировать,в частности ацетилировать. Ацетилирование реализовывают уксусным ангидридом либо хлористым ацетилом:
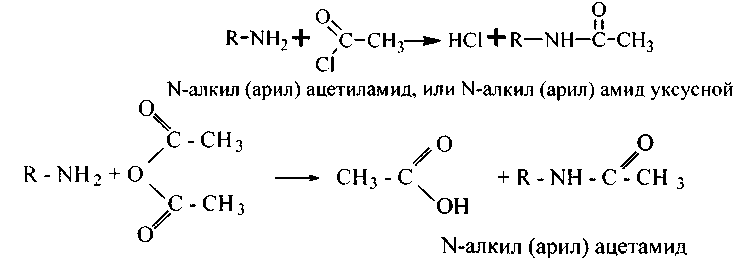
Реакции ацилирования идут при простых условиях, при комнатной температуре либо не сильный нагревании.
154.Напишите уравнения реакций и назовите продукты:
а) этиламин + вода; б) диметиламин + НСI; в) метилэтиламин + НВr; г) триметиламин + H2S04; д) анилин + H2S04; e) триметиламин + уксусная кислота; ж) анилин + уксусный ангидрид; з) этиламин + ацетилхлорид; и) п-толуидин + ацетилхлорид; к) о-толуидин + уксусный ангидрид; л) N- метиланилин + H2S04; м) N- диметиланилин + НСI.
4. Сотрудничество с азотистой кислотойаминов жирного последовательности (алкиламинов) происходит при простых условиях (на холоду).
Наряду с этим первичные амины дают спирты:
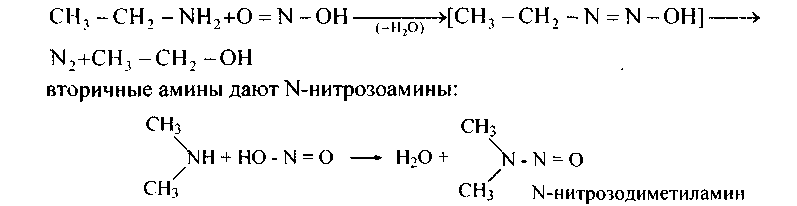
Азотистая кислота неустойчива, фактически берут ее соль и сильную минеральную кислоту.
Механизм растолковывают участием (+N=0) -нитрозоний-катиона:
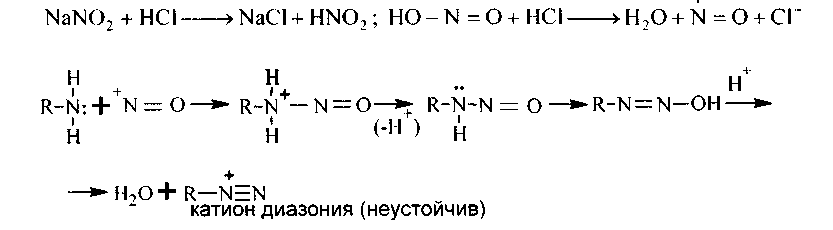
Катион арилдиазония достаточно устойчив при низкой температуре (см. реакцию диазотирования). Катион алкилдиазония разлагается сразу же в спирт (побочными продуктами являются алкены):
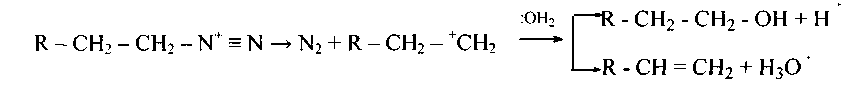
У вторичных аминов N-нитрозо-катион легко теряет протон, образуя устойчивый продукт реакции:
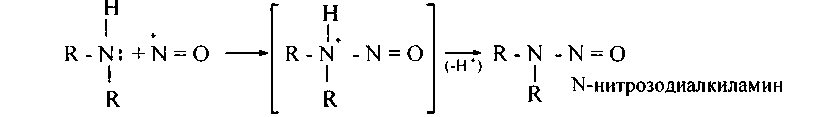
Третичные амины жирного последовательности дают лишь соли:
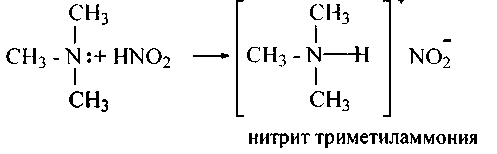
155.Напишите уравнения реакций сотрудничества следующих соединений-с азотистой кислотой и назовите полученные вещества:
а) трет-бутиламин; б) изопропиламин; в) этилизопропиламин; г) изобутиламин; д) метилпропиламин; е) втор-бутиламин; ж) этилендиамин; з) пропилендиамин-1,3; и) тетраметилендиамин (1,4-диаминобутан); к) 1,2-диаминопропан.
5. Сотрудничество с азотистой кислотойпервичных аминов ароматического последовательности имеет громадное значение и именуется реакцией диазотирования. Диазотирование выполняют при действии на водный раствор соли амина азотистой кислотой, приобретаемой из ее солей, в присутствии избытка минеральной кислоты (НС1 либо H2S04) :
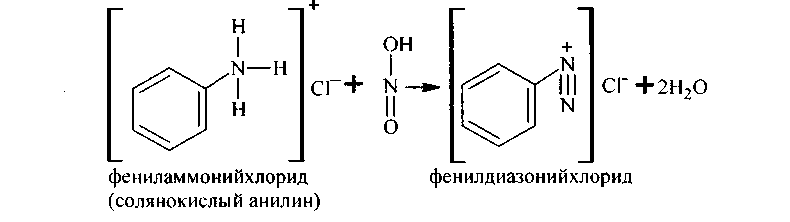
Полученные соединения именуются солями диазония, они подобны по всем особенностям солям аммония, но более активны и более неустойчивы. Так как соли диазония чувствительны к увеличению температуры, реакцию диазотирования ведут при температуре не выше +5°С, охлаждая смесь льдом.
156. Напишите уравнения реакций диазотирования следующих ароматических аминов и назовите полученные соединения:
а) анилин (фениламин); б) орто-толуидин (о-толиламин); в) пара-нитроанилин (п-нитрофениламин); г) мета-толуидин (м-толиламин); д) пара-сульфоанилин (п-сульфофениламин), либо сульфаниловая кислота; е) пара-толуидин (п-толиламин); ж) орто-нитроанилин (о-нитрофениламин); з) пара-этиланилин (п-этил-фениламин).
Вторичные аминыароматического последовательности реагируют с азотистой кислотой подобно вторичным аминам жирного последовательности, дают N-нитрозоамины:
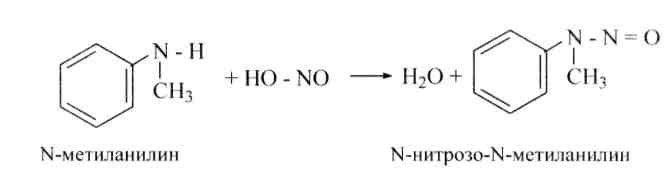
При действии минеральных кислот эти вещества перегруппировываются с перемещением нитрозо-группы в пара-положение ядра:
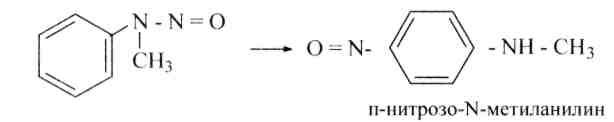
Третичные ароматические аминыдают с азотистой кислотой п-нитрозопроизводные1:
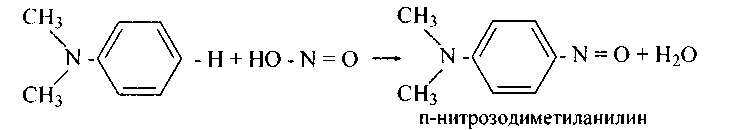
57.Напишите уравнения реакций сотрудничества азотистой кислоты со следующими соединениями и назовите полученные продукты: а) м-нитро-N-метиланилин; б) N-метил-N-этиланилин; в) п-этил-N-метиланилин; г) N-бензил-М-этиланилин; д) N-бензил-п-этиланилин; е) N-диметил-о-сульфоанилин; ж) п-нитро-N-метиланилин; з) п-сульфо-N-метиланилин.
Соли диазония, полученные в реакциях диазотирования первичных ароматических аминов смогут вступать в реакции обмена. К примеру, с основаниями они образуют основания диазония:
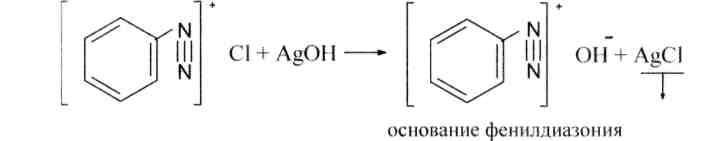
Основания диазония владеют амфотерными особенностями, с одной стороны, они смогут диссоциировать как основания:
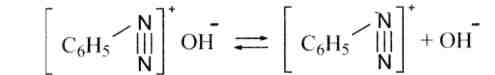
иначе, при действии более сильной щелочи смогут переходить в соли диазогидратов, либо диазотаты:
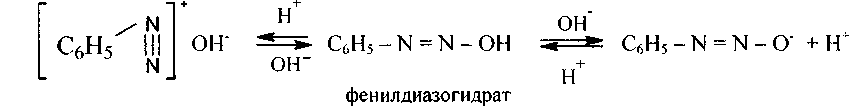
Соли диазония способны вступать в множество превращений и открывают путь к синтезу из аминов самых разных классов соединений. К примеру, сотрудничество и х с фенолами и аминами ведет к классу азокрасителей.Эта реакция носит название реакцииазосочетания.
6. Реакции азосочетания.Сотрудничество солей диазония с фенолами идет в слабощелочном растворе, с ароматическими аминами- в слабокислой среде.
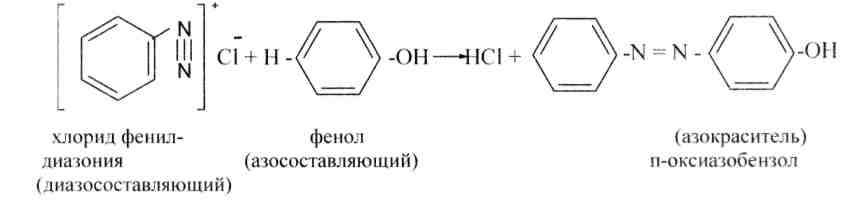
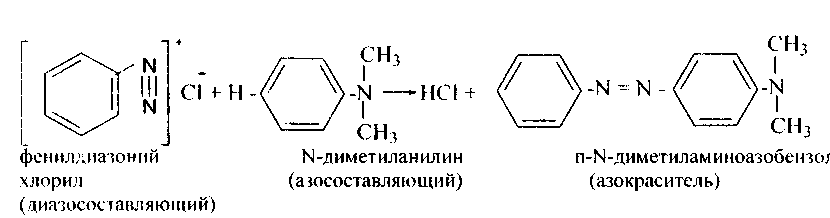
Сочетание постоянно идёт в пара-положение (в случае, если пара-положение занято, то в орто). Диазониевый ион замещает водород лучше в ароматическом ядре, содержащем сильноактивирующие группы, такие, как аминная либо гидроксильная. Сочетание не происходит в сильнокислой среде (благодаря образования солей аммония) и в сильнощелочной (благодаря образования диазотатов).
В реакциях азосочетания соли диазония именуются диазосоставляющими, а фенолы либо амины — азосоставляющими.
Азокрасителями довольно часто выполняют ледяное крашение: сперва обрабатывают ткань азосоставляющим (каким-либо фенолом либо амином), а после этого наносят рисунок ледяным раствором какой-либо соли диазония.
158.Напишите уравнения реакций азосочетания между следующими диазо- и азосоставляющими:
а) фенилдиазонийхлорид + N-диметиланилин; б) о-толилдиазонийхлорид + фенол: в) п-толилдиазонийхлорид + п-толуидин; г) феиилдиазонийхлорид + 2-метиламино-5-сульфо-бензойная кислота; д) п-сульфофенилдиазонийхлорид + N-диметиланилин: е) п-нитрофенилдиазонийхлорид + п-аминосалициловая кислота; ж) п-нитрофенилдиазонийхлорид + о-сульфо-N-диметиланилин; з) о-карбоксифенилдиазонийхлорид + N-диметиланилин,
159.Какие конкретно диазо- и азосоставляющие направляться применить для синтеза следующих азокрасителей:
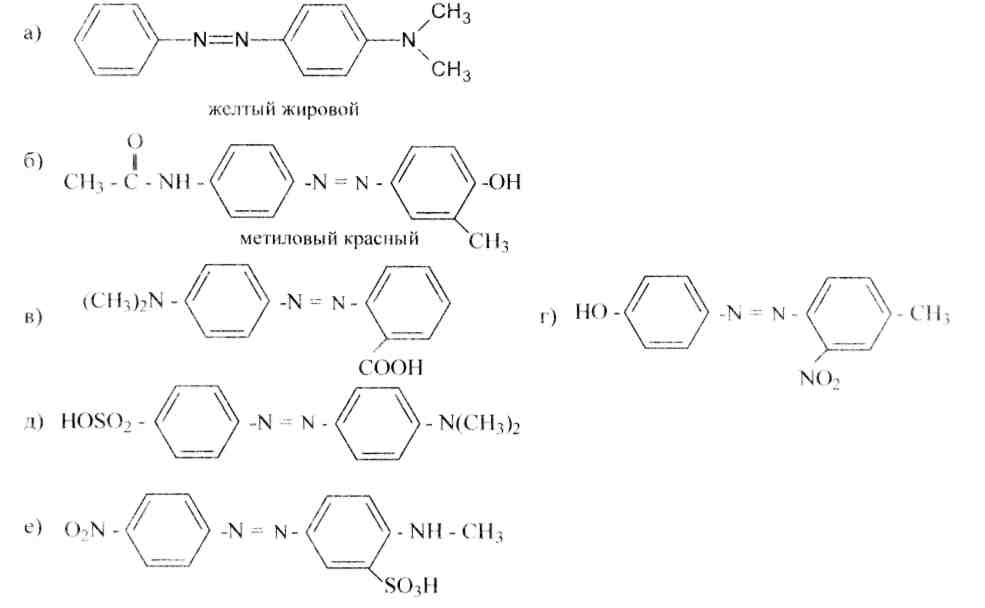
160.Как именно, исходя из анилина и N-диметиланилина, синтезировать азокрасители, имеющие следующие строения:
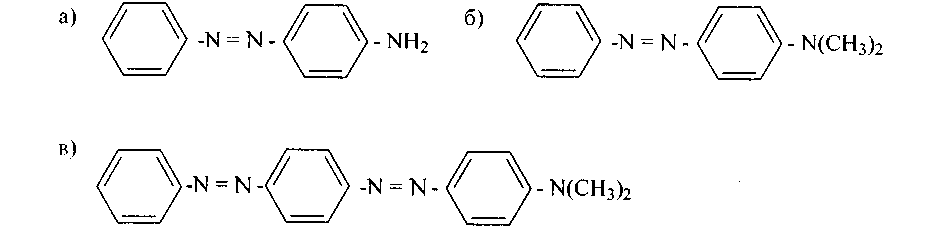
Личные задания по разделам
Опыт говорит о том, что личные задания, выданные студентам в начале преподавания курса с проверкой их исполнения по мере прохождения материала, стимулирует учебный процесс, повышают активность студентов на консультациях и занятиях.
Для исполнения личных заданий нужно пользоваться всей рекомендованной литературой.
Представленные ниже задания по углеводородам имеют 120 вариантов, которым соответствуют следующие номера упражнений: