Термодинамика настоящих газовых совокупностей.
К настоящим газам законы совершенных газов не применимы в полной мере строго. Но, понижая в достаточной степени давление, возможно любой газ при любой разрешённой температуре привести к такому состоянию, что отклонения от особенностей совершенных газов будут меньше какой-нибудь заданной конечной величины.
понижение температуры и Повышение давления, увеличивая концентрацию молекул газа и уменьшая расстояния между ними, усиливают отклонения особенностей данного газа от особенностей совершенного газа.
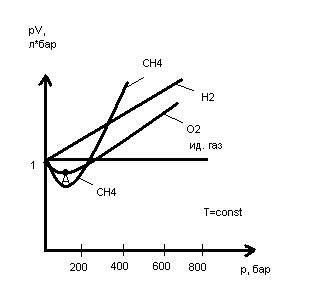
Для совершенных газов при любой постоянной температуре зависимость pV от p обязана изображаться прямой, параллельной оси давления. Но кое-какие изотермы имеют минимум (О2), где соблюдается условие pV=const (т.А).
Характер данной зависимости разъясняется тем, что при сжатии газа, вызывающем сближение его молекул, их обоюдное притяжение улучшается, и количество газа значительно уменьшается посильнее, т.е. произведение pV значительно уменьшается (участок 1 до т.А).
(Сжатие, сближение молекул , fГ-Г ?V v PV RT для одного моля газа).
Но при весьма сильном сближении молекул начинает оказаться наличие у них собственного количества (что не зависит от давления), и по мере предстоящего увеличения внешнего давления уменьшение количества газа происходит в меньшей степени, чем у совершенного газа.
(Р ^, ?V ^, fГ-Г RT для одного моля газа).
В области низких давлений все изотермы должны иметь горизонтальный участок, что не всегда виден в громадном масштабе. Это направляться из закона Бойля-Мариотта (pV=const).
Умелые эти говорят о том, что в области низких давлений (при 0º C) законы совершенных газов отлично применимы ко многим настоящим газам (N2, H2, O2, CO и т.д.).
Законы совершенных газов оптимальнее отражают поведение тех газов, каковые самый тяжело сжижаются, к примеру, водород, гелий, неон. Достаточно отлично эти законы обрисовывают поведение в простых условиях и при не через чур больших давлениях таких газов, как азот, кислород, аргон, окись углерода, метан, температура кипения которых близка к температуре кипения жидкого воздуха.
Для всех газов этих двух групп кроме того при увеличении давления до 50 бар, отклонения величины pV от значений, получающихся по уравнению состояния совершенного газа, не превышают 5%. Напротив, для легко конденсируемых газов: двуокиси углерода, двуокиси серы, хлора, хлористого метила и других – указанная величина обнаруживает соответствующие отклонения до 2-3% уже при атмосферном давлении. Так, для них использование закона совершенных газов в тех случаях, в то время, когда требуется более высокая точность результатов, не может быть оправдано кроме того для атмосферных условий.
Уравнение состояния настоящих газов.
Свойства настоящих газов закономерно отклоняются от особенностей совершенных газов. Благодаря этого требовалась разработка нового уравнения состояния, которое связывало бы между собой значения p, V и T и давало бы возможность, пользуясь ограниченным числом экспериментальных данных, вычислить кое-какие свойства газов для различных условий, не прибегая к дорогостоящим и не всегда дешёвым прямым измерениям.
Для предстоящего разбора вопроса мы обратимся к одному из самые ранних и самый изученных уравнений состояния настоящих газов – уравнению Ван-дер-Ваальса.
Это уравнение получается из уравнения состояния совершенных газов в следствии введения в него поправок на наличие у молекул собственного количества и на обоюдное их притяжение.
уравнение Ван-дер-Ваальса, отнесенное к одному молю вещества, воображают в большинстве случаев в виде:
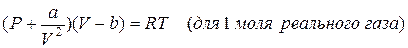
– поправка, учитывающая обоюдное притяжение молекул, которое действует как некое давление 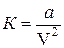 , сжимающее газ. Его именуют внутренним давлением и уверены в том, что оно обратно пропорционально квадрату количества.
, сжимающее газ. Его именуют внутренним давлением и уверены в том, что оно обратно пропорционально квадрату количества.
а – свойство молекул к обоюдному притяжению.
в – поправка, учитывающая личный взаимное отталкивание и объём молекул между ними при малых расстояниях.
Не считая уравнения Ван-дер-Ваальса применяют ряд других уравнений состояния настоящих газов:
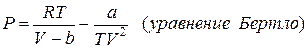
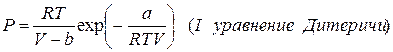
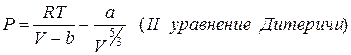
Все уравнения записаны для 1 моля газа, a и b – личные постоянные газов.
С высокой точностью поведение любого настоящего газа возможно обрисовать посредством вириального разложенияпо степеням обратного количества:
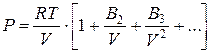
либо давления:
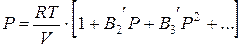
где В2, В3 и т.д. (В2?, В3? и т.д.) – вириальные коэффициенты, каковые зависят от температуры.
В2 – второй вириальный коэффициент; В3 – третий вириальный коэффициент.
Уравнение состояния совершенного газа и вириальное уравнение состояния настоящего газа возможно вывести способами статистической термодинамики.
Время от времени уравнения состояния настоящих газов записывают через так именуемые приведенные переменные, каковые высказывают через параметры критического состояния газов:
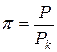 ;
; 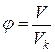 ;
; 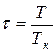
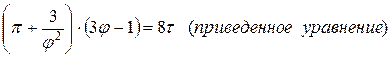
Pk, Vk, Tk – критическое давление, количество, температура газов.
Критические параметры определяются как координаты точек перегиба на изотерме настоящего газа.
Свойства совершенных и настоящих газов отличаются из-за наличия сотрудничества между молекулами настоящего газа. Мерой отклонения от совершенного поведения помогает фактор сжимаемости 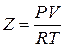 . Для совершенных газов Z=1.
. Для совершенных газов Z=1.