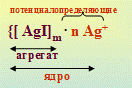
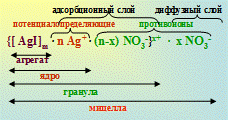
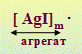KI + AgNO3 = AgI + KNO3
Принципиально важно: золь образуется из весьма разбавленных растворов.
1) при избытке нитрата серебра образуется хороший золь.
Таблица 2.
Между заряженной диффузионным слоем и гранулой появляется двойной электрический слой (ДЭС) – разность потенциалов –электрокинетический потенциал либо дзета-потенциал (?).
2) при избытке иодида калия образуется отрицательный золь:
{[AgI]m · n I- · (n-x) K+ }х- · x K+
либо {m[AgI] · n I- · (n-x) K+ }х- · x K+
|
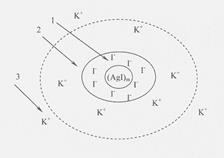
Рис. 2. Схема ДЭС частицы гидрозоля AgI: 1 – адсорбционный слой потенциалобразующих ионов; 2 – плотный слой противоионов; 3 – диффузный слой противоионов. |
Образование гидрофобного золя сульфата бария:
BaCl2 + K2SO4 = BaSO4 + 2KCl
a) избыток сульфата калия:
n K2SO4 2nK+ + nSO42-
{[BaSO4]m · nSO42- · 2(n-x) K+ }2х- · 2xK+
б) избыток хлорида бария:
n BaCl2 nBa2+ + 2nCl-
{[BaSO4]m · nBa2+ · 2(n-x) Cl- }2х+ · 2xCl-
Гранула может не иметь заряда. Такое состояние коллоидной совокупности именуется изоэлектрическим. Дзета-потенциал равен нулю.
6. Свойства коллоидных совокупностей:
1) Молекулярно-кинетические.
а) Свойства, которые связаны с тепловым перемещением частиц — броуновское перемещение, диффузия, осмотическое давление, температуры замерзания, кипения и др. – у коллоидных растворов выражены не сильный, чем у подлинных растворов. Это связано с громадными размерами коллоидных частиц и меньшей концентрацией, при однообразной массе веществ.
б) Седиментация – оседание коллоидных частиц под действием силы тяжести. Этому противодействует диффузия. Со временем устанавливается седиментационное равновесие, при котором концентрация дисперсной фазы равномерно понижается от нижних слоев к верхним и остается постоянным во времени.
2) Оптические особенности. Коллоидные частицы имеют диаметр меньше ½ длины световой волны, исходя из этого допустимо дифракционное рассеивание света. Путь светового луча, проходящего через прозрачный коллоидный раствор, на чёрном поле, делается видимым – отмечается конус Тиндаля. Это явление похоже на рассеяние света запыленным воздухом. При пропускании света через подлинные растворы конус Тиндаля не отмечается – они прозрачные. При пропускании света через взвесь частицы отражают свет, отмечается освещенность всего раствора, и они выглядят мутными.
Помимо этого, окраска бесцветного золя зависит от освещения: в отраженном свете светло синий-светло синий цвет, в проходящем свете – желто-красный. Отмечается опалесценция(переливчатое свечение), появляющаяся из-за рассеивания света на флуктуациях (неоднородностях) плотности, благодаря дифракции.
К примеру: светло синий цвет неба (капельки воды, флуктуации плотности газов атмосферы), сигаретного дыма, керосина, обезжиренного молока. Красный цвет небесных светил при размещении вблизи горизонта.Применение оптических особенностей коллоидных совокупностей: нефелометрия, турбодиметрия, ультрамикроскопия.
3) Электрокинетические особенности – электрофорез и электросмос, потенциал седиментации и потенциал течения.
4) Устойчивость коллоидных совокупностей (способ. рук-во, стр. 167-168): седиментационная, агрегативная устойчивость лиозолей. Коагуляция. Порог коагуляции.
| Cп(Х) = | Сэл • Vэл • 1000 Vр-ра + Vэл | Cп(Х) – порог коагуляции, ммоль/л (миллимоль электролита на 1л золя). Сэл – исходная концентрация, моль/л; | |
| Vэл – мельчайший количество раствора электролита, вызывающий коагуляцию, л; Vр-ра – количество коллоидного раствора, л. | |||
Коагулирующая свойство К.С. = 1/ Cп(Х)
Правило Щульце-Гарди. К.С. = f(z6).
Перезарядка коллоидных частиц. Явление привыкания. Антагонизм, синергизм, аддитивность. Обоюдная коагуляция. Пептизация.
7. Защита коллоидных совокупностей.
8. Коллоидные ПАВ. Биологически серьёзные коллоидные ПАВ (мыла, детергенты, желчные кислоты). Фундаментальные особенности водных растворов ПАВ. Мицеллообразование в растворах ПАВ. Критическая концентрация мицеллообразования – ККМ. Солюбилизация. Определение критической концентрации мицеллообразования.