Естественное содержаниесульфатов в поверхностных и грунтовых водах обусловлено биохимическими процессами и выветриванием пород в водоносных слоях. Их содержание определяет в известной мере некарбонатную жесткость воды. Содержание солей серной кислоты в водоемах возможно повышенным благодаря сброса в них сточных вод с неорганическими и органическими соединениями серы. Концентрация сульфат – ионов воздействует на механизмы водно–солевого обмена у гидробионтов.
Содержание сульфат-ионов по ГОСТ 2974-82 не должно быть больше 500 мг/л. Большее количество сульфата нежелательно, поскольку ухудшаются органолептические показатели воды и возрастает ее агрессивность.
Сущность способа
Содержание сульфат-ионов определяют комплексонометрическим способом с трилоном Б. В исследуемую воду вводят ионы Ba2+ (раствор BaCl2), каковые с ионами SO образуют осадок:
Ba2+ + SO = BaSO4 ¯ (41)
При сотрудничестве трилона Б с ионами Ba2+ образуется комплексное соединение. Содержание солей серной кислоты определяется по отличию расхода трилона Б для связывания ионов бария до и по окончании осаждения ионов SO . Потому, что в исследуемой воде имеется ионы Ca и магния, то на эти ионы нужно делать соответствующие поправки.
оборудование и Реактивы
– исследуемая вода;
– соляная кислота, 0,1 н раствор;
– метиловый красный;
– раствор BaCl2, содержащего ионы Мg (10 г BaCl2.2.H2O и 4 г МgCl2.6.H2O в 1л);
– мерная колба либо пипетка количеством 50 мл;
– коническая колба количеством 200…250 мл;
– электроплитка.
Проведение анализа
В коническую колбу вместимостью 200 мл отмеривают пипеткой 50 мл исследуемой воды, прибавляют 1–2 капли раствора метилового красного и подкисляют раствор 0,1 н раствором соляной кислоты. После этого кипятят раствор 3…5 мин. для удаления углекислого газа. К кипящему раствору прибавляют 1мл раствора хлорида бария, содержащего ионы магния (10 г BaCl2.2H2O и 4 г МgCl2.6H2O в 1 л ) и кипятить еще 10…15 с. Наличие в растворе ионов магния нужно для более четкого определения финиша титрования трилоном Б.
После этого, трилонометрическим способом определяют концентрацию сульфат- ионов.
4. Санитарно-бактериологический анализ воды
При стандартном санитарно-бактериологическом анализе воды санитарное состояние характеризуют двумя главными показателями:
– общим числом бактерий в воде;
– числом бактерий группы кишечной палочки (бактерий Coli).
4.1. Определение общего числа бактерий в воде
Сущность способа
Способ пребывает в определении количества бактерий в 1 мл воды, каковые способны расти на питательной среде (агаре) определенного состава при температуре 37 °С в течение 24 ч, образуя колонии, видимые при повышении в 2…5 раз. Совершённым так бактериологическим анализом возможно выяснить количество лишь тех бактерий, каковые развиваются в условиях анализа. Исходя из этого такое определение дает не полную, а относительную бактериологическую чёрта воды. Бактериологический анализ разрешает сравнивать бактериальную зараженность воды, отобранной из различных мест водоисточника, и из одного его места в различные времена года.
Общее число бактерий в 1 мл средней пробы неразбавленной хозяйственно-питьевой воды допускается не более 100.
реактивы и Оборудование
– чашки Петри стерильные;
– три пипетки на 1 мл;
– пипетка на 10 мл;
– стерильные пипетки на 0,1мл;
– стерильные пробирки;
– навески питательной среды (питательный огар) либо пробирки с питательным МПА;
– электроплитка;
– термометр;
– спиртовка;
– спички;
– стеклянная палочка прямая и изогнутая;
– спирт;
– маркер;
– проба воды из водоема.
Проведение анализа
В чашку Петри пипеткой вносят 1 мл исследуемой питьевой воды* а после этого заливают пробу 10…12 мл питательного мясо-пептонного агара, имеющего температуру ~45 °С. Содержимое скоро перемешивают, с опаской наклоняя и вращая чашку по поверхности стола. Нужно избегать образования пузырьков воздуха, не залитых участков дна чашки, попадания питательной среды на ее края и крышку. Затем чашку ставят на горизонтальную поверхность до застывания среды, а после этого помещают в термостат и выдерживают при температуре 37,5 °С в течение 24 ч. За это время в чашках Петри вырастает от 30 до 300 колоний бактерий, каковые видны при повышении в 2…5 раз** По взятым и приведенным в табл. 4.1 данным определяют степень загрязнения воды.
Таблица 4.1
Зависимость степени загрязнения воды от общего количества бактерий
| Черта воды | Количество бактерий в 1 мл воды |
| Весьма чистая Чистая Умеренно загрязненная Загрязненная Нечистая Весьма нечистая | а ? 1,0 а ?102 а ? 103 а ? 104 а ? 105 а ? 106 |
Примечание: а имеет значение от 1 до 9.
4.2. Определение количества бактерий группы кишечной палочки
При бактериологическом изучении воды в первую очередь ставится цель установить, заражена ли вода вредными бактериями, возбудителями тифа, холеры, дизентерии. Потому, что выяснить наличие этих бактерий весьма тяжело, то в большинстве случаев бактериологический анализ воды сводится к обнаружению бактерий группы кишечной палочки, каковые для человека не страшны, но присутствие их говорит о загрязнении воды фекалиями и приводит к подозрению о наличии в воде вредных микроорганизмов.
Сущность способа
Обнаружение бактерий группы кишечной палочки основано на их способности, в отличие от вторых бактерий, размножаясь, сбраживать сахар. В случае, если питательная среда одержит молочный сахар, то он сбраживается до молочной кислоты, которая разрушает соединение фуксина сульфитом. В местах роста колоний бактерий Coli образуются окрашенные фуксином красные блестящие холмики, по числу которых делают выводы о количестве бактерий Coli.
Содержание в воде бактерий группы кишечной палочки характеризуют коли-титром, что численно равен количеству воды в миллилитрах, содержащему одну кишечную палочку. Титр кишечной палочки есть решающим показателем санитарного состояния воды. В случае, если одна кишечная палочка содержится в 100 мл воды, то такая вода считается чистой, в случае, если в 10 мл — достаточно чистой, в 1 мл – вызывающе большие сомнения чистой. При наличии одной кишечной палочки в 0,1 мл воду вычисляют очень сильно загрязненной и негодной для питья.
Для обеззараженной и осветленной воды, применяемой для хозяйственно-питьевых целей, коли-титр в отдельном определении должен быть не ниже 300–330 мл. Загрязнение воды кишечными палочками характеризуют кроме этого коли-индексом — числом кишечных палочек в 1 л воды. В соответствии с ГОСТ 2874-82, коли-индекс питьевой воды не должен быть больше 3.
Для определения количества бактерий группы кишечной палочки существует два способа: бродильный и мембранных фильтров. Сущность последнего способа пребывает в концентрировании бактерий из определенного количества исследуемой воды на выращивании и мембранном фильтре их при температуре 37 ± 0,5 °С в среде Эндо. При данной температуре создаются оптимальные условия для выращивания бактерий.
оборудование и Материалы
– мембранные фильтры;
– водоструйный насос;
– проба исследуемой воды количеством не меньше 500мл;
– среда Эндо;
– стерильные чашки Петри;
– стерильные пинцеты;
– спиртовка;
– пробирки с дистиллированной водой;
– микробиологическая петля;
– микроскоп;
– красители для окраски по Граму;
– предметное и покровное стекло.
Проведение анализа
В фильтровальный аппарат* помещают стерильный мембранный ультрафильтр, забрав его обожженным пинцетом из сосуда, в котором проводилась стерилизация. Под мембранный ультрафильтр подкладывают простерилизованный кружок фильтровальной бумаги, намоченный стерильной водой.
Для фильтрования берут 300…500 мл воды. В случае, если вода сточная, то ее предварительно разбавляют стерильной водой в 100…1000 раз.
По окончании окончания фильтрования мембранный ультрафильтр снимают обожженным пинцетом с рас и прибора полагают на поверхности фуксинсульфитного агара (среда Эндо), помещенного в чашку Петри. После этого чашку помещают вверх дном в термостат при температуре 37 °С на 24 ч. Через 24 ч подсчитывают колонии бактерий, окрашенные в красный цвет с железным блеском.
После этого рассчитывают коли-титр, мл
Коли-титр = , (42)
либо коли-индекс:
Коли-индекс = 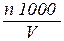 . (43)
. (43)
Тут n – количество бактерий группы кишечной палочки (n), выращенных из исследуемого количества воды(V). На основании результатов определения неспециализированного микробного числа и коли-индекса делают вывод о бактериологической безопасности воды.
5. Биологический контроль водоема по гидробионтам — индикаторам
5.1. Изучение биоразнообразия микроорганизмов природного водоема по морфологическим показателям прямым микроскопированием и определение индекса сапробности водоема по индикаторным организмам.
Сущность способа
Биоразнообразие микроорганизмов различных экологических групп водного биоценоза есть серьёзным условием устойчивости интенсивности экосистемы и существования водоёма протекающих в нем процессов самоочищения. На трансформации, происходящие в водоеме, а также антропогенное загрязнение, биоценоз чутко реагирует трансформацией характера и интенсивности собственного метаболизма, трансформацией видового состава. Исходя из этого способ биоиндикации удачно употребляется для изучения состояния водных экосистем.
Самый созданной совокупностью оценки степени загрязнения вод по индикаторным организмам есть совокупность сапробности Кольквитца-Маарссона. В 1908 г. учеными Р.Кольквитцем и М.Маарссоном была создана шкала оценки загрязненности водоемов по присутствию в них тех либо иных организмов.
Под сапробностью понимается комплекс физиологических особенностей организма, обусловливающий его свойство развиваться в воде с тем либо иным содержанием органических и токсических веществ, т.е. той либо другой степенью загрязнения.
В хорошей совокупности сапробности показательные организмы разделяются на три группы:
– полисапробионты – организмы очень сильно загрязненных вод;
– мезосапробионты – организмы умеренно загрязненных вод (подразделяются на две подгруппы – a- и b-);
– олигосапробионты – организмы слабозагрязненных вод.
Существует последовательность способов представления результатов гидробиологического анализа, разрешающих оценить среднюю сапробность водного биоценоза. Одним из самые удобных способов есть способ Пантле и Букка.
Этот способ разрешает оценивать сапробность водного объекта по фитопланктону, зоопланктону либо бентосному сообществу по отдельности либо в их совокупности.
Количественная оценка гидробионтов по способу Пантле и Букка учитывает относительную частоту встречаемости организмов – h и отношение отдельных видов к известным степеням совокупности сапробности – s. Обе эти размеры входят в формулу сапробности территории либо водоема
S = 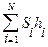 /
/ 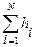 ,(44)
,(44)
где Si — индикаторная значимость вида i, либо расширенный сапробный индекс вида i (по В.Сладечеку); hi — относительная численность вида i; N — численность видов-индикаторов.
Величина h находится из шестиступенчатой шкалы значений частоты и определяет относительное количество видов (Приложение 6, табл. 1).
Дополнительной чёртом территорий сапробности являются химико-биологические показатели качества воды водоема, которая дана в Приложении 7.
Индекс сапробности вычисляют с точностью до 0,01. Для ксеносапробной территории он находится в пределах 0…0,50, олигосапробной — 0,51…1,5, b-мезосапробной — 1,51…2,50, a-мезосапробной — 2,51…3,50, полисапробной — 3,51…4,00. Пример расчета индекса сапробности по способу Пантле и Букку представлен в приложении 8.
оборудование и Материалы
– микроскоп;
– предметные и покровные стекла;
– пипетка глазная;
– склянка пенициллиновая либо бюкс;
– кисточка;
– колба мерная на 250 и на 500;
– фильтры мембранные №5 либо 6;
– насос водоструйный;
– воронка;
– фильтр бумажный;
– дистиллированная вода.
Отбор проб
Отбор проб из водоема либо водотока для анализа осуществляется перед исполнением работы. Для изучения отбирают 0,5…1,0 л воды посредством батометра либо несложным зачерпыванием пластиковой бутылкой на глубине не более 0,2…0,5м от дна. По окончании наполнения, часть воды сливается из бутылки так, дабы над водой оставалось воздушное пространство и после этого бутылка закрывается крышкой. При необходимости придонный слой воды легко взмучивают (при бедных зоо- и фито- планктоном вод).
Движение исполнения работы
Отобранную пробу сгустить посредством водоструйного насоса либо методом фильтрования через бумажный фильтр «тёмная лента», засунутый в воронку и предварительно намоченный дистиллированной водой. Минимальный количество для сгущения образовывает 250 мл. При фильтровании пробу нужно всегда взбалтывать. После этого фильтр с осевшим материалом помещают в бюкс либо склянку, куда додают 5…10 мл фильтрата. После этого фильтр с опаской очищают от осадка мягкой кисточкой. Для микроскопирования отбирают каплю взятой суспензии микроорганизмов глазной пипеткой, предварительно отлично взбалтывая пробу, и помещают на чистое, сухое, обезжиренное предметное стекло. Сверху с опаской покрывают покровным стеклышком так, дабы под ним по возможности не осталось пузырьков воздуха. Первые один – два раза микроскопирование выполняют с целью ознакомления с микробами и определения их принадлежности к разным таксонометрическим группам. Отлично видимый объект зарисовывается и идентифицируется по таблицам, определителю и рисункам. Узнается принадлежность организма к тому либо иному классу, виду.
Для определения индекса сапробности исследуемого водоема направляться:
1. Совершить микроскопирование сконцентрированной пробы с отбором капли не меньше 3…5 раз;
2. Идентифицировать встречаемые виды, выяснить их принадлежность к территории сапробности, выписать по определителю Сладечека В. класс, название и вид каждого определенного микроорганизма, и расширенный индекс сапробности si;
3. Фиксировать относительную частоту встречаемости каждого вида в микроскопируемых каплях, результаты подсчета заносить в таблицу 5.1.
Таблица 5.1
| Наименование вида | Сапробность исследуемой территории | S | hh | Sh |
4. Зарисовать любой встречаемый вид.
5. Вычислить индекс сапробности для исследуемого водоема раздельно по фито- и зоо- планктону по формуле, сравнить с существующими чертями, сделать вывод о принадлежности водоема к той либо другой территории сапробности.
6. Оценка трофических особенностей водоема
6.1. Определение деструкции и первичной продукции органического вещества
Ответственной чёртом биологической продуктивности водоема есть деструкция и первичная продукция органического вещества.
Первичная продукция – это продукция органического вещества, образованного растительными клетками в ходе фотосинтеза. Первичная продукция делается органической пищей для животных организмов разных трофических уровней и, так, определяет уровень биологической продуктивности водоема. Различают валовую Рвал и чистую Рчист первичную продукцию.
Валовая продукция – это общее число органического вещества, появившееся в ходе фотосинтеза.
Чистая продукция учитывает дыхание гидробионтов, другими словами деструкцию органического вещества.
Деструкция органического вещества характеризуется развитием процессов разложения органического вещества. деструкция и Первичная продукция есть кроме этого ответственными чертями состояния водоема с позиций качества воды. Для оценки состояния водоема применяют показатель индекса самоочищения. Индекс самоочищения – это отношение валовой первичной продукции к суммарной деструкции органического вещества.
Для определения первичной продукции фитопланктона обширно применяют способ измерения по трансформации концентрации кислорода в воде (скляночный способ) и другие способы.
Сущность способа
Скляночный способ измерения деструкции фитопланктона и первичной продукции по отличию выделения кислорода в ходе фотосинтеза за определенный период, в первый раз был предложен Граном и Руудом и подробно создан Винбергом Г.Г. В базе способа лежит валовое уравнение фотосинтеза:
СО2 + Н2О – (СН2О) + О2 , (45)
в котором количество потребленной углекислоты либо количество выделившегося при фотосинтезе кислорода пропорционально количеству образованного органического вещества. При отсутствии света реакция идет в обратном направлении – процесс дыхания (деструкции), разложения органического вещества с выделением углекислоты и потреблением кислорода.
Для определения первичной продукции сперва отбирают пробу воды и определяют в ней содержание растворенного кислорода (и/либо углекислого газа). После этого отбирают еще две пробы в яркие склянки, каковые экспонируют на глубине отбора пробы в течение 8 часов и опять определяют концентрацию растворенного кислорода (либо углекислоты). Экспонировать склянки нужно до либо по окончании полудня.
При определении деструкции вторую пробу воды отбирают не в яркие, а в чёрные склянки. После этого, как и при определении продукции склянки экспонируют на глубине отбора проб и определяют концентрацию растворенных в воде газов. Концентрацию растворенного кислорода определяют способом Винклера, концентрацию углекислоты нейтрализацией щелочью. Количество склянок образовывает 100–500 мл в зависимости от продуктивности водоема: для эвтрофных водоемов употребляются склянки на 100 мл, для мезотрофных – на 250 мл, для олиготрофных — на 500 мл.
Первичная продукция (деструкция) будет пропорциональна разнице начальной и конечной концентрации кислорода в пробе по окончании экспонирования.
Определение деструкции и первичной продукции в большинстве случаев выполняют для горизонтов разной освещенности. Горизонты измерения первичной продукции должны соответствовать глубинам, куда попадает 100, 75, 50, 10, и 1% поверхностной солнечной радиации. Глубина, на которую попадает 1% солнечной радиации, именуется нижней границей фотического слоя и соответствует равновесию разложения биомассы и процессов производства. Наряду с этим первичная продукция равна деструкции. Граница фотического слоя соответствует утроенной глубине прозрачности по белому диску. Остальные горизонты фотического слоя определяют пропорционально глубине границы фотического слоя. В случае, если фотический слой не превышает 5 м, то склянки погружают на глубины 0, 0,5, 1, 2, 3, 4, 5 м.
реактивы и Оборудование
Склянки с притертыми пробками из яркого прозрачного стекла – 3 шт., 1 склянка с притертой пробкой из чёрного стекла, продукционные плотики либо штатив, батометр, реактивы для фиксации растворенного определения и кислорода по способу Винклера (см. с. 31).
Подготовка к отбору проб. Продукционные склянки, посуда и батометр для анализа должны быть шепетильно вымыты и высушены. Склянки нужно расставить в порядке отбора проб с горизонтов. На любой горизонт нужно четыре склянки – одну для определения начальной концентрации О2, две яркие и одна чёрная для экспонирования проб.
Отбор, фиксация и экспонирование проб. В точке отбора измеряют прозрачность воды и определяют глубину фотического слоя, умножая прозрачность на 3. По окончании отбора проб батометром срочно начинают заполнять продукционные склянки. Перед заполнением любая склянка ополаскивается исследуемой водой. Склянки заполняются доверху, переливая часть пробы. Заполнять необходимо с опаской, дабы исключить попадание пузырьков воздуха. Попавшие в склянку пузырьки воздуха удаляют, покинув склянку открытой в течение одной 60 секунд и постукивая по стенкам склянки. направляться избегать попадания прямых солнечных лучей. Пробу для определения начальной концентрации кислорода фиксируют, в соответствии с методике. Остальные склянки закрывают и ставят на экспонирование на соответствующий горизонт, предварительно отлично закрепив. направляться отметить время начала экспозиции. По окончании экспозиции фиксируют остальные пробы, и выполняют расчёт и необходимые определения растворенного кислорода.
Расчет деструкции и первичной продукции.В случае, если Vс количество О2 в яркой склянке по окончании экспонирования, Vт количество О2 в чёрной склянке по окончании экспонирования, t – время экспозиции ч, Vн с — начальное содержание кислорода в склянке перед экспонированием, то первичную продукцию Р (мг О2 л/ч) вычисляют по следующим формулам:
валовая продукция
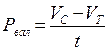 ; (46)
; (46)
чистая продукция
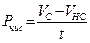 ; (47)
; (47)
деструкция
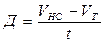 ; (48)
; (48)
6.2. Оценка трофических особенностей водоема с применением высших водных растений-индикаторов
Высшие водные растения среди групп водных организмов-индикаторов являются наименее изученным звеном, не смотря на то, что имеют последовательность преимуществ. Они являются видимый невооруженным глазом и исходя из этого очень удобный для наблюдения объект, и позволяют при рекогносцировочном гидробиологическом осмотре водоемов в первом приближении визуально оценить их экологическое состояние. Макрофиты разрешают выяснить трофические особенности воды, а время от времени и специфику ее химизма, что имеет значительное значение при биоиндикации вод.
Сущность способа
В прибрежно-водной растительности выявляется только легко поддающаяся учету доминантная флора. Наряду с этим подтипу водной растительности, представленной гидромезофитными, гидрофитными и гигрофитными видами, отводится принципиальная роль в оценке загрязнения водной среды. Подтипу же прибрежной растительности, представленной гигрофитными, мезофитными и ксеномезофитными видами, определяющее значение придается при оценке загрязнения донных отложений малорастворимыми токсическими веществами.
При ботанической индикации водоемов целесообразно учитывать следующие показатели: степень покрытия его макрофитами, флористическое разнообразие растений, отклонения в росте и развитии. При последующих лабораторных изучениях, при необходимости, определяется последовательность количественных продукции: величины и характеристик фитомассы, масса и высота стебля, состав растений.
Громадную роль при индикации вод играется наличие определенных видов- индикаторов. Но в обнаружении таких растений имеется последовательность трудностей потому, что многие из них владеют широкими экологическими и географическими ареалами. Более того, в разных физико-географических условиях эти растения индикаторы смогут видеться в водоемах неодинакового трофического статуса и иметь соответственно разное индикаторное значение. Ограниченность сведений об физиологии и экологии большинства видов макрофитов кроме этого есть лимитирующим причиной при обнаружении индикаторных видов.
По общепринятой классификации стоячие водоемы (озера, естественные пруды и т.п.) делятся на, дистрофные, олиготрофные, мезотрофные, и эвтрофные (Приложение 9).
Количественная оценка водоёма и уровня по присутствию макрофитов индикаторов учитывает относительную частоту их встречаемости и отношение отдельных видов к принятой совокупности трофности водоемов.
Для каждого уровня трофности водоемов принят номер: дистрофные – 1, олиготрофные – 2, мезотрофные – 3, эвтрофные – 4. Частоту встречаемости учитывают по девятибальной шестиступенчатой шкале со следующими обозначениями: 1 – весьма редко, 2 – редко, 3 – часто, 5 – довольно часто, 7 – часто, 9 – масса.
Неспециализированный уровень трофности водоема вычисляется по формуле
Т = SТi аi/Sаi , (49)
где Тi – уровень трофности соответствующего вида-индикатора;
а – частота встречаемости вида.
Пример расчета трофности водоема по высшим водным растениям дан в приложении 9.
Движение исполнения работы
– применяя каталоги-определители, дать наименование каждому растению;
– оценить частоту встречаемости каждого вида;
– выделить доминантные и субдоминантные виды;
– выделить индикаторные виды присутствующие в водоеме;
– вычислить неспециализированную трофность водоема по растениям-индикаторам;
– зарисовать и привести заглавия всех распознанных растений, указать индикаторные виды, охарактеризовать трофические особенности водоема.
7. Подсчет клеток микроорганизмов в счетных камерах
Сущность способа
Способ прямого счета микробных клеток в счетных камерах – один из самые быстрых и достаточно правильных. Этот способ удачно используется для определения общего числа микроорганизмов, содержащихся во взвесях. Но счетные камеры Горяева, Нажотта смогут быть использованы только для подсчета довольно больших объектов – клеток водорослей, дрожжей грибов, микроскопируемых при повышении микроскопа (окуляр 10–15´, объектив 8–40´).
подготовка и Устройство камеры Горяева
Счетная камера Горяева представляет собой толстое предметное стекло с прямоугольным углублением в центре. Глубина камеры образовывает 0,1+0,005 мм. На дне углубления нанесена сетка из 400 квадратов. Сторона сетки соответствует 3+0,005 мм, площадь одного малого квадрата соответствует 1/400 мм2, громадного – 1/25 мм2.
Каплю с микробами помещают в центр камеры и накрывают особым покровным стеклом, шепетильно притирая его по краям камеры до появления ньютоновских колец. Наряду с этим толщина слоя жидкости в камере над сеткой соответствует 0,1 мм, а количество камеры 0,9 мм3 (около 1мм3). Любой небольшой квадрат ограничивает количество жидкости в 1/4000 мм3 , либо 1/4000000 мл (1 мл = 1000 мм3).
Подсчет клеток в камере начинают через 3…5 мин. по окончании заполнения ее, в то время, когда клетки осели и расположились в одной плоскости. Подсчет клеток ведут в большинстве случаев в 10 громадных или в 20 малых квадратах, перемещая их по диагонали. Количество клеток в громадном квадрате не должно быть больше 20, а в малом – 10.
Для получения точного результата неспециализированное число подсчитанных клеток микроорганизмов должно быть не меньше 600, исходя из этого из исследуемой взвеси микроорганизмов берут 3 – 4 пробы для монтажа камеры.
оборудование и Материалы
– счетная камера Горяева;
– водоструйный насос;
– мембранные фильтры № 5,6;
– колба на 500мл с пробой природной воды;
– склянка на 20мл из-под пенициллина;
– пипетка глазная;
– микроскоп;
– кисточка колонковая;
– формалин 40%.
Проведение анализа
Пробу природной воды содержащей водоросли, количеством 500 мл, сгущают посредством водоструйного насоса на мембранном фильтре. В конце фильтрования нужно следить, дабы над фильтром остался узкий слой воды. После этого сгущеный осадок с фильтра с опаской переносят в склянку при помощи кисточки и доводят до количества 5мл дистиллированной водой. Консервируют препарат формалином либо раствором Люголя.
По окончании тщательного взбалтывания, каплю взвеси с водорослями из склянки наносят в центр счетной камеры пипеткой. Счетную камеру накрывают покровным стеклом, шепетильно притирая его с краев до образования ньютоновских колец (цветных полос).
Подсчет клеток в камере начинают через три – пять мин. по окончании ее заполнения, в то время, когда клетки осели и расположились водной плоскости. Подсчет клеток ведут в большинстве случаев в 10 громадных или в 20 малых квадратах, перемещая их по диагонали.
Для статистической достоверности в каждой пробе нужно выяснить и просчитать все виды как минимум несколько раз с последующим вычислением среднего арифметического. Пересчет неспециализированной численности производится по формуле
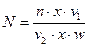 (50)
(50)
где N– число клеток в 1 мл воды,n – число клеток в камере количеством 1мм3;
v1 – количество концентрата пробы (5 мл);
v2 – количество камеры в мл (0,001);
w – количество профильтрованной воды (500 мл);
Отчет по работе обязан содержать:
– расчет неспециализированной численности водорослей;
– расчет численности главных видов;
– картинки довольно часто видящихся видов.
Библиографический перечень
1. Константинов А.С. Гидробиология. – М.: Верховная школа, 1979. – 490 с.
2. Макрушин А.В. Биологический анализ качества вод. – Л.: 1974. – 153 с.
3. Таубе П.Р., Баранова А.Г. микробиология и Химия воды. – М.: Верховная школа, 1983. – 280 с.
4. Радкевич В.А. Экология. – Минск: Верховная школа, 1998. – 159 с.
5. Бокрис Дж. Химия экологии. – М.: Мир, 1984. – 480 с.
6. Карюхина Т.А., Чурбанова И.Н. Химия микробиология и воды. – М.: Стройиздат, 1983. – 215 с.
7. Павлович С.А. Медицинская микробиология. – М.: Верховная школя, 1998. – 173 с.
8. Управление к лабораторным работам по микробиологии и химии воды/Составители: Л.З. Казанцева, О.Г. Дубровина; Под ред. Л.З. Казанцевой. Челябинск: ЧПИ, 1984. – 47 с.
9. Управление к экологической практике: Учебное пособие / Н.И. Ходоровская, Я.Н. Лепп, А.В. Лагунов и др. – Челябинск: Изд. ЮУрГУ, 1999. – Ч.1. – 67 с.
10. Кульский Л.А. и др. микробиология и Химия воды: Практикум/ Л.А. Кульский, Т.М. Левченко, М.В. Петрова. – Киев: Вища школа, 1976, – 116 с.
11. Лейте В. Определение органических загрязнений питьевых, природных и сточных вод/Пер. с нем.; Под ред. Ю.Ю. Лурье. – М.: Химия, 1975. – 200 с.
12. Управление по способам гидробиологического анализа поверхностных вод и донных отложений; Под ред. В.А. Абакумова. – Л.: Гидрометеоиздат, 1983. – 240 с.
13. Определитель гидробионтов/ Под ред. В. Сладечека. – М.: СЭВ, 1977. – 227 с.
ПРИЛОЖЕНИЯ
Приложение 1