Рябухин Ю.И.
Неспециализированная ХИМИЯ
Учебное пособие
Астрахань
УДК 54 (075.8)
ББК 24.1в644я73
Неспециализированная химия: учебное пособие/ Составитель Рябухин Ю.И. – Астрахань: Астрахан. гос. техн. ун-т, 2012. – 111 с.
Подготовлено на базе учебного пособия Барагузиной В.В., Богомоловой И.В., Федоренко Е.В. Неспециализированная и неорганическая химия (М.: Изд-во РИОР, 2006. – 272 с.)
Соответствует федеральным национальным стандартам высшего профобразования.
Рекомендуется студентам нехимических специальностей и направлений, и студентам профессий среднего профобразования.
Критик: кандидат химических наук, доцент Лебедева А.П.
Печатается согласно решению кафедры Неспециализированная, неорганическая и аналитическая химия (протокол № 7 от 27 июня 2012 г.)
© Астраханский национальный
технический университет, 201 2
ХИМИЯ: ОПРЕДЕЛЕНИЕ, ЗАДАЧИ,
ЗНАЧЕНИЕ, ГЛАВНЫЕ ПОНЯТИЯ
Химия– наука, изучающая превращения и строение веществ, сопровождающиеся трансформацией их состава и/либо строения.
В химии объекты изучают со стороны химической химической динамики и статики.
Химическая статикавключает учения о составе веществ (химические соединения), об их структуре, химическом равновесии и свойствах.
Химическая динамикавключает в себя учения об элементарном химическом акте, о скоростях и механизмах химических реакций[1].
Значение химии.Установлениезависимости особенностей веществ от их строения и состава, механизмов и условий химических реакций разрешило осуществлять синтез новых веществ. В следствии открытий в области теории строения органических теории и соединений окислительно-восстановительных процессов были созданы новые полимерные материалы, химические источники и пластические массы энергии.
Химия занимает серьёзное место среди базисных отраслей индустрии. Знания химии употребляются в производстве минеральных удобрений, цемента, полупроводниковых, очень чистых и других материалов с нужными для науки и техники чертями, синтетических смол, нитей и химических волокон, химических продуктов нефтяной и газовой индустрии.
ГЛАВНЫЕ ТЕРМИНЫ
Химический элемент[2] – определённый вид (совокупность – общее число) атомов с однообразным зарядом ядра.
А. е. м.с. 32-37
Атом[3] складывается из положительно заряженного окружающих и ядра его отрицательно заряженных электронов, образующих электронную оболочку.
Нуклид(с.10).
Молекула [4] – мельчайшая частица данного вещества, владеющая его химическими особенностями, каковые определяются её строением и составом.
Формульная единица (с.26).
Простое, либо элементарное вещество [5] – вещество, образованное атомами одного химического элемента. К примеру, с.16.
Сложное вещество – вещество, образованное атомами различных химических элементов. К примеру, с. 18.
Химические явления – явления, при которых одни вещества преобразовываются в другие, но наряду с этим не происходит трансформации состава ядер их атомов элементов.
Физические явления – явления, при которых изменяется форма либо физическое состояние веществ либо образуются новые вещества за счёт трансформации состава ядер атомов, следовательно, исчезновение одних и появление вторых химических элементов.
2. СТЕХИОМЕТРИЧЕСКИЕ[6] ЗАКОНЫ
2.1. ЗАКОН СОХРАНЕНИЯ МАССЫ[7]
Принцип: «В химической реакции не имеет возможности происходить происхождения либо исчезновения материи[8]».
Формулировка закона: «Масса веществ, вступивших в химическуюреакцию (реагентов), равна массе веществ, появившихся в результатереакции (продуктов реакции)».
К примеру, в случае, если 4 г водорода сгорают в кислороде с образованием 36 г воды, значит в данной реакции принимают участие 32 г кислорода:
4 г 32 г 36 г
Объяснение закона с позиций атомно-молекулярного учения:
в следствии химической реакции происходит только перегруппировка атомов в веществе(ах), т. е. существующие химические связи между атомами разрываются и образуются новые, но число атомов до и по окончании реакции остаётся неизменным. Исходя из этого масса веществ в химической реакции не изменяется.
энергии и Взаимосвязь массы выражается соотношением
Альбера Эйнштейна (энергии сохранения и закон массы):
,
где Е – энергия; m –масса; с –скорость света в вакууме (3•108 м/с, либо
300 000 км/с).
Изменение массы за счёт энерговыделения нельзя обнаружить в химических реакциях. Это разъясняется тем, что величина с2большая и исходя из этого энергии, выделяющейся либо поглощающейся в химических реакциях, соответствует очень малый масса, которую фактически нельзя измерить.
В случае, если, к примеру, при реакции хлора с водородом образуется 1 моль хлороводорода НСl, то выделяется 92,3 кДж энергии. Данной энергии соответствует масса, равная 10–9 г. В ядерных реакциях (к примеру, при распаде ядер атома урана либо плутония), напротив, выделяется энергия, в миллионы раз громадная, чем при химических реакциях, что ведет к большому трансформации массы.
ЗАКОН ПОСТОЯНСТВА СОСТАВА
Основоположник:французский химикЖозеф Луи Пруст (1799-1808).
Формулировка закона:«Химическое соединение, независимо от метода его получения, имеет одинаковый состав».
Данный закон честен для веществ молекулярного строения, но большая часть неорганических веществ в простых условиях не имеет молекулярного строения и в кристаллах этих веществ молекул нет.
Так, состав оксидов титана(IV) и ванадия(II) не нужно изображать химическими формулами ТiО2 (более правильная формула ТiО1,9 – ТiО2) и VO (в зависимости от условий получения состав этого оксида возможно от VО0,9 до VО1,3). Отклонения от закона постоянства состава незначительные и при составлении химических формул они, в большинстве случаев, не учитываются.
Эти отклонения были обнаружены русским химиком Н.С. Курнаковым (1912-1913). Вещества молекулярного строения, каковые подчиняются закону постоянства состава, он назвал дальтонидами(по имени британского химика и физика Д. Дальтона), а вещества немолекулярного строения – бертоллидами(по имени французского химика К. Бертолле, что предвидел существование таких веществ).
Более правильная формулировка закона:«Всякое чистое (личное) вещество молекулярного строения имеет постоянный состав, независимо от метода его получения. Состав вещества немолекулярного строения зависит от условий и способа его получения».
Нужно кроме этого учитывать изотопный состав химических элементов: в простой воде, к примеру, массовая часть элемента водорода образовывает 11,19 %, а в тяжёлой воде – 20 %.
ЗАКОН КРАТНЫХ Взаимоотношений
Основоположник:британский химик и физикДжон Дальтон (1803).
Формулировка закона: «В случае, если два химических элемента А и В смогут связываться между собой, образуя пара различных химических соединений, то весовые (массовые) количества элемента А, каковые связываются с постоянным весовым (массовым) числом элемента В, пропорциональны маленьким целым числам».
Пример: вода – Н2О и пероксид водорода – Н2 О2. Так как
Относительные ядерные веса кислорода и водорода соответственно
равны 1 и 16, то массовое отношение Н : О для воды равняется 2:16, либо
1: 8 ,а для пероксида водорода – 2 : 32, либо 1 : 16.
ЗАКОН ЭКВИВАЛЕНТОВ
Основоположники:Вениамин химик — и немецкий технолог Рихтер (1791) и британский химик Уильям Волластон (1807).
Химический эквивалент– это условная частица, в целое число раз меньшая либо равная соответствующей ей формульной единицы: атома, молекулы, иона, радикала и др.
Число, обозначающее долю формульной единицы, именуется причиной эквивалентности (безразмерная величина, обозначаемая fэкв). Фактор эквивалентности не есть величиной постоянной, и его рассчитывают на основании стехиометрических коэффициентов данной реакции.
К примеру, в случае, если в кислотно-оснoвной (обменной) реакции между гидроксидом натрия и сероводородной кислотой:
H2S + 2NaOH = Na2S + H2O
участвуют оба атома водорода H2S и образуется сульфид натрия, то формульной единице NaOH эквивалентна условная частица, равная ½ молекулы H2S, и,следовательно, fэкв (H2S) = ½.
В случае, если же H2S и NaOH забраны в таких отношениях, что в следствии реакции образуется гидросульфид натрия:
H2S + NaOH = NaНS + H2O,
то в молекуле H2S замещается только один атом водорода. И, следовательно, формульной единице NaOH эквивалентна условная частица, равная молекуле H2S, и fэкв (H2S) = 1.
В окислительно-восстановительной реакции горения сероводорода в кислороде:
2H2S + 3О2 = 2H2O + 2SO2
степень окисления атомов серы изменяется с –2 до +4, и, следовательно, молекула H2S теряет 6 электронов, т. е. одному электрону эквивалентна условная частица, равная 1/6 молекулы H2S, и fэкв (H2S) = 1/6.
Так, в зависимости от того, в какую реакцию вступает вещество, его эквивалент будет различным, причём фактор эквивалентности возможно меньше либо равен единице:
fэкв ? 1.
Количество вещества химического эквивалента измеряется в молях.
Молярная масса эквивалента, либо эквивалентная масса (Мэкв) – это масса 1 моль химических эквивалентов. Она равна произведению фактора эквивалентности на молярную массу вещества. К примеру, для вышеприведённых реакций молярные веса эквивалентов H2S вычисляются по формуле
Мэкв (H2S) = fэкв (H2S) · М(H2S):
Мэкв (H2S) = ½ · 34,06 = 17,03 г/моль;
Мэкв (H2S) = 1 · 34,06 = 34,06 г/моль;
Мэкв (H2S) = 1/6 ·34,06 = 5,68 г/моль.
Из определения молярной массы химического эквивалента направляться формулировка закона эквивалентов: «Массы (количества) реагирующих и образующихся веществ относятся между собой как молярные веса их эквивалентов».
Вывод:в химические реакции вступают либо образуются в следствии реакции эквивалентные количества веществ, либо количества, пропорциональные молярным весам (количествам) их эквивалентов:
m(А)/Мэкв(А) = m(В)/Мэкв(В) = V(B)/Vэкв(B).
Для примера вычислим, чему равна молярная масса эквивалента атома хлора в НСl. В соответствии с определению, молярная масса химического эквивалента – это масса одного моля эквивалентов, которая присоединяет либо замещает молярную массу атомов водорода. Исходя из этого молярная масса эквивалента атома хлора в НС1 равна молярной массе атомов хлора – 35,453 г/моль.
Разглядим реакцию кислорода с водородом:
По закону эквивалентов, отношения весов веществ, вступающих в химическую реакцию либо образующиеся в качестве её продуктов, равны либо кратны молярным весам их эквивалентов:
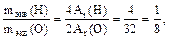
где mэкв(Н) и mэкв(О) –эквивалентные веса кислорода и водорода соответственно, а Аr(Н) и Аr(О) – их относительные ядерные веса [9].
Так, водород может взаимодействовать с кислородом с образованием воды лишь в массовом соотношении 1 : 8 и ни в каком втором.
ЗАКОН АВОГАДРО
Основоположник: физик и итальянский химик Амедео Авогадро (1811).
Формулировка закона: «В равных количествах разных газов при однообразных внешних условиях (температура, давление) содержится однообразное число молекул (либо атомов, при добропорядочных газов)».
Следствие из закона Авогадро: при однообразных условиях равные количества разных газов занимают равные количества.
При обычных условиях(н. у.): при температуре Т =273,15 К (0 °С) и давлении р = 101 325 Па (1 атм, 760 мм рт. ст.) – любой газ (близкий по особенностям к совершенному газу, т. е. газу, отвечающему следующим условиям: отсутствие сотрудничеств между молекулами; размеры молекул значительно меньше расстояний между ними, идеально упругие столкновения молекул между собой и со стенками сосуда), количество которого равняется одному молю, занимает количество 22,4 л. Эта физическая постоянная именуется молярным количеством газапри обычных условиях. Единица молярного колличества газа – л/моль; при н. у. Vm= 22,4 л/моль.
3. Периодическая СИСТЕМА и ПЕРИОДИЧЕСКИЙ ЗАКОН ХИМИЧЕСКИХ ЭЛЕМЕНТОВ Д.И. МЕНДЕЛЕЕВА[10]
ИСТОРИЯ СИСТЕМАТИЗАЦИИ
ХИМИЧЕСКИХ ЭЛЕМЕНТОВ
Германский химик И.В. Деберейнер (1816) поделил химические элементы в группы по три (на триады)на базе сходства в особенностях образуемых ими веществ. Пример триад: Li, Nа, К; С1, Вr, I.
Американский химик Д.А.Р.Ньюлендс (1865) пробовал расположить химические элементы в порядке возрастания их ядерных весов и нашёл сходство между каждым восьмым по счёту элементом, начиная с любого, подобно строению музыкальной октавы, складывающейся из восьми звуков (закон октав).Но ему не удалось удовлетворительно растолковать отысканную закономерность.
Германский химик Л.Мейер (1864) расположил химические элементы в порядке повышения их ядерных весов в виде таблицы, в которую поместил 27 элементов (меньше половины известных в то время), размещение вторых элементов было неясным.
Д.И. Менделеев (1869) открыл периодический закон: «Свойства несложных тел, и свойства и формы соединений элементов находятся в периодической зависимости от величины их ядерных весов».
До Менделеева исследователи преследовали лишь классифи-кационные цели и не шли дальше объединения отдельных химических элементов в группы на основании сходства их химических особенностей. Наряду с этим любой новый элемент рассматривался как что-то обособленное, не пребывающее в связи с другими элементами. Менделеев был уверен, что между всеми химическими элементами обязана существовать закономерная сообщение, объединяющая их в единое целое, и пришёл к заключению, что в базу систематики элементов должен быть положен их относительный ядерный вес.Расположив все элементы в порядке возрастающих ядерных весов (весов), Менделеев понял, что сходные в химическом отношении элементы видятся через определённые промежутки, соответственно, в последовательности элементов многие их свойства иногда повторяются.
Классификацию химических элементов Менделеев выразил в виде периодической совокупности в форме таблицы.Ко времени открытия периодического закона было известно 63 химических элемента, обрисованы свойства и состав многих их соединений.
Главная ЗАКОНОМЕРНОСТЬ
ПЕРИОДИЧЕСКОГО ЗАКОНА
Разглядим подряд по возрастающей относительной ядерной массе первые 20 химических элементов, начиная с лития (пропустим водород и гелий).
Литий– деятельный металл, энергично разлагающий воду с образованием щёлочи.
Бериллий– также металл, но менее деятельный, медлительно разлагающий воду при простой температуре.
Бор – трёхвалентный элемент со слабо выраженными неметаллическими особенностями, проявляющий, но, кое-какие свойства металла.
Углерод– четырёхвалентный неметалл.
Азот– элемент с достаточно быстро выраженными особенностями неметалла.
Кислород– обычный неметалл.
Фтор– самый деятельный из неметаллов, находящийся в собствености к группе галогенов.
Так, железные особенности, четко выраженная у лития, понемногу ослабевают при переходе от одного химического элемента к второму, уступая место неметаллическим особенностям, каковые наиболее проявляются у фтора. Одновременно с этим по мере повышения относительной ядерной массы степень окисления атомов элементов, начиная с лития, возрастает на единицу для каждого следующего элемента до азота. Исключение из данной закономерности воображает атом фтора, степень окисления которого равна минус единице, а валентность – единице, и атом азота, степень окисления которого равна плюс пяти, а валентность не превышает четырёх, что связано с изюминками строения этих атомов.
Если бы изменение особенностей и дальше происходило кроме этого, то по окончании фтора следовал бы химический элемент с ещё более сильно выраженными неметаллическими особенностями. В конечном итоге же следующий за фтором элемент неон представляет собой добропорядочный (инертный) газ, не соединяющийся с атомами вторых элементов, другими словами не проявляющий ни железных, ни неметаллических особенностей.
За неоном идёт натрий – металл, похожий на литий. За натрием направляться магний – аналог бериллия,позже алюминий,не смотря на то, что и металл, вместе с тем, как бор, обнаруживающий кое-какие неметаллические особенности. По окончании него идут кремний – четырёхвалентный неметалл, во многих отношениях сходный с углеродом; пятивалентный фосфор,по химическим особенностям похожий на азот; сера – элемент с быстро выраженными неметаллическими особенностями; хлор– весьма энергичный неметалл, находящийся в собствености к той же группе галогенов, что и фтор, и, наконец, снова добропорядочный газ аргон.
В случае, если проследить изменение особенностей остальных химических элементов, то окажется, что оно происходит в таком же порядке, как и у первых шестнадцати (не считая водорода и гелия) элементов: за аргономопять идёт калий, после этого металл кальций, сходный с магнием, и т. д.
Так, изменение особенностей химических элементов по мере возрастания их относительной ядерной массы не совершается непрерывно, а имеет периодический темперамент. Через определённое число происходит как бы возврат элементов к исходным особенностям, по окончании чего в определённой мере снова повторяются свойства прошлых элементов в той же последовательности, но с некоторыми качественными и количественными отличиями.
ЭЛЕМЕНТОВ: ГРУППЫ И ПЕРИОДЫ
Период– горизонтальная последовательность химических элементов, расположенных по возрастанию заряда ядер их атомов, начинающаяся щелочным металлом и заканчивающаяся добропорядочным газом (особенный случай – первый период, складывающийся из двух элементов – Н и Не).
В первом ряду находятся лишь два элемента – водород и гелий. Эти элементы составляют первый период. Второй и третий последовательности складываются из восьми элементов и образуют два периода по восемь элементов в каждом. Эти периоды начинаются со щелочного металла и заканчиваются добропорядочным (инертным) газом. Первые три периода именуются малыми периодами.
Четвёртый последовательность кроме этого начинается со щелочного металла – калия. В отличие от двух прошлых периодов на седьмом месте находится не галоген, а марганец – металл, образующий как главные, так и кислотные оксиды, из которых только верховный оксид Мn2О7 подобен соответствующему оксиду хлора – С12О7. По окончании марганца в том же последовательности находятся ещё три металла – железо, никель и кобальт, весьма сходные по особенностям между собой. И лишь следующий, пятый последовательность, начинающийся с меди, заканчивается добропорядочным газом криптоном. Шестой последовательность опять начинается со щелочного металла и т. д. Так, у элементов, следующих за аргоном, более либо менее полное повторение особенностей отмечается лишь через 18 элементов, а не через 8, как было во втором и третьем периодах. Эти 18 элементов образуют четвёртый период, складывающийся из двух последовательностей (громадной период).
Пятый–громадный –период составляют следующие два последовательности, шестой и седьмой; данный период начинается щелочным металлом рубидием и заканчивается добропорядочным газом ксеноном.
В восьмом последовательности по окончании лантана находятся 14 элементов – лантаниды, каковые сходны по особенностям с лантаном и между собой (неспециализированный принцип строения атомов). Исходя из этого лантаниды в большинстве случаев помещают вне неспециализированной таблицы, отмечая только в клетке для лантана их положение в периодической совокупности.
Потому, что следующий за ксеноном добропорядочный газ радон находится лишь в конце девятого последовательности, то восьмой и девятый последовательности образуют один громадный период–шестой, содержащий 32 химических элемента.
В громадных периодах отмечается ещё одна особенность в трансформации особенностей химических элементов. Так, верховная валентность атомов сначала равномерно растёт при переходе от одного элемента к второму, но после этого, достигнув максимума в середине периода, падает до одного-двух, по окончании чего снова возрастает до семи к концу периода. Исходя из этого громадные периоды поделены любой на два последовательности.
Десятый последовательность, составляющий седьмой период, содержит 32 химических элемента, из которых первый – франций (Fr) и последние 26 элементов взяты недавно неестественным путём. Следующие за актинием 14 химических элементов сходны по строению их атомов; исходя из этого их называющиеся актиниды, кроме этого как и лантаниды, помещают вне неспециализированной таблицы.
Группы(всего  – вертикальные столбцы таблицы, в которых находятся химические элементы, владеющие сходными особенностями. Номера групп в большинстве случаев отмечают вверху римской цифрой.
– вертикальные столбцы таблицы, в которых находятся химические элементы, владеющие сходными особенностями. Номера групп в большинстве случаев отмечают вверху римской цифрой.
Химические элементы, входящие в первую группу, образуют оксиды с неспециализированной формулой Э2О, во вторую – ЭО, в третью – Э2О3 и т. д. Так, громаднейшая степень окисления атомов элементов каждой группы соответствует практически в любое время номеру группы.
Особенности трансформации особенностей в группах.Начиная с пятого последовательности (четвёртый период) любой химический элемент в одной группе обнаруживает громаднейшее сходство не с элементом, расположенным под либо над ним, а с элементами, отделёнными от него одной клеткой. К примеру, в седьмой группе бром не примыкает конкретно к иоду и хлору, а отделён от хлора марганцем, а от иода – технецием; находящиеся в шестой группе сходные элементы – теллур и селен поделены молибденом, очень сильно отличающимся от них по особенностям; находящийся в первой группе рубидий обнаруживает громадное сходство с цезием, стоящим в восьмом последовательности, но мало похож на расположенное под ним серебро и т. д.
Объяснение: с четвёртого последовательности начинаются громадные периоды, состоящие любой из двух последовательностей, расположенных один над вторым. Потому, что в пределах периода восстановительные особенности химических элементов ослабевают в направлении слева направо, то в каждом громадном периоде у элементов верхнего (чётного) последовательности они выражены посильнее, чем у элементов нижнего (нечётного) последовательности. Дабы отметить различие между последовательностями, элементы первых последовательностей громадных периодов перемещены в таблице периодической совокупности влево, а элементы вторых – вправо.
Так, начиная с четвёртого периода, каждую группу периодической совокупности возможно разбить на две подгруппы: «чётную», складывающуюся из химических элементов верхних последовательностей, и «нечётную», грамотного элементами нижних последовательностей. Элементы малых – второго и третьего – периодов (названных Д.И. Менделеевым типическими) в первой и второй группах ближе примыкают по своим особенностям к элементам чётных последовательностей, в других – к элементам нечётных последовательностей. Исходя из этого типические элементы в большинстве случаев объединяют со сходными с ними элементами чётных либо нечётных последовательностей в одну основную подгруппу(несколько А), вторая подгруппа именуется побочной(несколько В).
Д.И. МЕНДЕЛЕЕВА
Периодическая совокупность Д.И. Менделеева стала первой естественной классификацией химических элементов, продемонстрировавшей, что элементы образуют стройную совокупность и находятся в тесной связи между собой.
На протяжении разработки периодической совокупности многие химические элементы были ещё малоизвестны (всего было известно 63 элемента). Был малоизвестен элемент четвёртого периода скандий. По относительной ядерной массе за кальцием шёл титан, но его не было возможности поставить сразу после кальция, поскольку титан попал бы в третью группу, в то время как он образует верховный оксид ТiО2, и по вторым особенностям должен быть отнесён к четвёртой группе. Исходя из этого Менделеев пропустил одну клетку, покинув свободное место между титаном и кальцием. На том же основании в четвёртом периоде между мышьяком и цинком были покинуты две свободные клетки, занятые сейчас элементами германием и галлием. Свободные места были покинуты и в других последовательностях.
Менделеев был не только уверен, что должны существовать малоизвестные ещё химические элементы, но и заблаговременно предсказал и обрисовал свойства некоторых из них (скандий Sс, галлий Ga, германий Gе), основываясь на определённых для них положений среди вторых элементов периодической совокупности.
Громадно значение периодической совокупности кроме этого в исправлении и установлении относительных ядерных валентности и масс атомов некоторых химических элементов.
Ключевую роль периодический закон сыграл в разработке теории строения вещества.
СТРОЕНИЕ АТОМА
ЭЛЕКТРОН
Продолжительное время считалось, что атомы неделимы (не содержат составных частей) и неизменны (атом данного химического элемента не имеет возможности преобразовываться в атом другого элемента). В конце XIX в. был установлены факты, свидетельствовавших о сложном строении атомов элементов и о возможности взаимопревращений атомов различных элементов.
В 1897 г. британский физик Джозеф Томсоноткрыл электрон– элементарную частицу, владеющую мельчайшим существующим в природе отрицательным зарядом (1,602?10-19 Кл). Его масса спокойствия (9,1095?10–31 кг) в 1836 раз меньше массы спокойствия протона (1,6726?10–27 кг). Было обнаружено, что электроны смогут быть выделены из атомов любого элемента: так как они являются носителями электричества в металлах, испускаются многими веществами при нагревании, освещении либо рентгеновском облучении, обнаруживаются в пламени.
Электроны находятся в атомах всех элементов, но они заряжены отрицательно, а атомы не владеют зарядом – электронейтральны.Следовательно, в атомах, не считая электронов, находятся другие, положительно заряженные частицы, другими словами атомы– сложные образования, выстроенные из более небольших структурных единиц.
Громадную роль в установлении сложной природы атома и расшифровке его структуры сыграло изучение и открытие радиоактивности– явления испускания атомами некоторых химических элементов излучения, талантливого попадать через вещества, ионизировать воздушное пространство, приводить к почернению фотографических пластинок.
Значение теории Резерфорда
Был установлен физический суть порядкового (ядерного) номера химического элемента в периодической совокупности Д.И. Менделеева: порядковый номер был серьёзной константой химического элемента, высказывающей хороший заряд ядра его атомов. Из электронейтральности атома направляться, что и число вращающихся около ядра электронов равняется порядковому номеру химического элемента.
Это открытие дало новое обоснование размещению химических элементов в периодической совокупности и устранило кажущееся несоответствие – размещение некоторых элементов с большей относительной ядерной массой в первых рядах элементов с меньшей относительной ядерной массой (иод и теллур, калий и аргон, никель и кобальт). Место химического элемента в периодической совокупности определяется зарядом ядер его атомов.Было экспериментально установлено, что заряд ядер атомов теллура равен 52, а атомов иода – 53; исходя из этого теллур, не обращая внимания на бoльшую относительную ядерную массу, обязан пребывать в таблице периодической совокупности до иода. Заряд калия атомов и ядер аргона, кобальта и никеля абсолютно отвечают последовательности размещения этих элементов в периодической совокупности.
Так, современная формулировка Свойства и периодического: «закона химических элементов (в образуемых ими несложных и сложных веществах) находятся в периодической зависимости от заряда ядер их атомов».
Определение порядковых номеров химических элементов по заряду ядер их атомов разрешило установить общее число мест в периодической совокупности элементов между водородом, имеющим порядковый номер 1, и ураном (порядковый номер 92), считавшимся во времена Менделеева последним участником данной совокупности. В то время, когда создавалась теория строения атома, оставались незанятыми места 43, 61, 72, 75, 85 и 87, что говорило о возможности существования ещё неоткрытых химических элементов. В 1922 г. был открыт элемент гафний (72 место), в 1925 г. – рений (75 место). Элементы, каковые должны занять остальные четыре свободных места таблицы периодической совокупности, были радиоактивными и в природе не отысканы, но их удалось взять неестественным путём. На данный момент все клетки таблицы периодической совокупности химических элементов между ураном и водородом заполнены, но сама совокупность не есть завершённой, не смотря на то, что уже открыто 26 трансурановых элементов и ожидается открытие элементов, каковые будут вырабатывать восьмой период.
4.4 УРАВНЕНИЕ ШРЁДИНГЕРА[11].
Атомов химических элементов
• по таблице периодической совокупности Д.И. Менделеева определяют
порядковый (ядерный) номер химического элемента, что равен количеству электронов в электронейтральном атоме;
• записывают (п, l)-последовательность;
• заполняют (заселяют) ядерные орбитали в соответствии с их большой ёмкостью.
К примеру, определим электронную конфигурацию атома хлора. В соответствии с периодической совокупности химических элементов, его порядковый (ядерный) номер равен 17. Следовательно, количество электронов в электронейтральном атоме хлора равняется 17. Записываем (п, l)-последо-вательность:
1s – 2s – 2p – 3s – 3p – 3d – …
Заполняем (заселяем) ядерные орбитали:
17С1: 1s22s22p63s23p53d0 .
Электронная формула обрисовывает электронную конфигурацию атомов химических элементов.
ХИМИЧЕСКАЯ Сообщение
ПОНЯТИЕ ХИМИЧЕСКОЙ СВЯЗИ
Учение о природе химической связи даёт ответы на следующие вопросы.
По какой причине одни атомы соединяются в молекулы, а другие таковой свойством не владеют?
По какой причине у молекулы появляются свойства, отличающиеся от особенностей образующих её атомов?
Почемуодни молекулы весьма устойчивы, а другие распадаются на атомы уже в простых условиях?
По какой причине кое-какие вещества складываются из ионов, а другие – из молекул?
По современным представлениям химическая сообщение имеет электрическое происхождение. В её образовании участвуют в основном внешние электроны атомов.Между ядрами и электронами атомов появляются электростатические силы притяжения, удерживающие атомы приятель около приятеля в виде молекул либо кристаллов.
В большинстве случаев условно выделяют три типа химической связи: ковалентную, ионную и железную.Ковалентная сообщение по собственной природе представляет собой универсальный тип химической связи. Ионную же сообщение возможно разглядывать как предельный случай ковалентной связи между атомами, быстро отличающимися по электроотрицательности. Железная сообщение характерна лишь для их сплавов и металлов и имеет ту же природу, что и ковалентная сообщение, отличаясь лишь некоторыми изюминками.
Для объяснения природы ковалентной связи и механизма её образования применяют в большинстве случаев две теории, узнаваемые называющиеся способ валентных связей(способ ВС) и способ молекулярных орбиталей(способ МО). В теоретической химии господствует способ МО.
ЭЛЕКТРООТРИЦАТЕЛЬНОСТЬ
Под электроотрицательностью(Л. Полинг[15])(ЭО) понимается свойство атома в молекуле либо сложном ионе притягивать электроны, участвующие в образовании связи.
Это понятие употребляется для оценки разных особенностей химической связи. Но электроотрицательность не есть сродством атома к электрону, потому, что она относится не к изолированным, а к химически связанным атомам. Электроотри-цательность атома в молекуле воображает свойство соперничать с другими, которые связаны с ним атомами, в притяжении неспециализированных электронов, участвующих в образовании между ними химических связей.
Электроотрицательность связана со склонностью изолированного атома удерживать собственные внешние электроны (энергия ионизации атома – Еи), и со склонностью изолированного атома притягивать дополнительные электроны (сродство к электрону – Еср). Исходя из этого электроотрицательность атома довольно часто рассматривается как функция (полусумма значений) этих двух видов энергии:
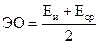 .
.
Чем больше химических связей у атома, тем большей свойством он владеет к передаче электронов, и электроотрицательность его обязана изменяться с трансформацией степени окисления. Так, атом серы в молекуле SС12, без сомнений, должен иметь б?льшую ЭО, чем атом серы в молекуле SF6, в которой он теряет большее число электронов. Однако допускается, что значение ЭО для первого атома в молекуле не зависит от числа химических связей с другими атомами. За ЭО i-го атома элемента принимают некую эмпирическую, усреднённую величину.
Шкала относительных электроотрицательностей (ОЭО) Полинга запланирована на базе термохимических данных. В данной шкале произвольно принята величина ОЭО самый электроотри-цательного электронейтрального атома фтора, равная 4,0. Электронейтра-льному атому каждого химического элемента приписывается в полной мере определённое значение ОЭО, не зависящее от партнёров, с которыми этот атом вступает в химические связи.
В каждом периоде периодической совокупности химических элементов ОЭО возрастает слева направо, т. е. с повышением порядкового (ядерного) номера элемента, а в каждой группе убывает, в большинстве случаев, сверху вниз. Так, с повышением электроотрицательности электронейтральных атомов элементов их восстановительные особенности ослабевают. Чем дальше отстоят атомы элементов друг от друга по шкале ОЭО, тем б?льшую склонность они выявляют к образованию ионной связи.
При составлении химических формул соединений из атомов элементов — неметаллов более электроотрицательные из них указываются правее, к примеру:BN1, BCl3, CH4, NH3, H2O, HCl, Cl2O, ClO, ОF2, BrCl, Вr3N и т. д.
МЕХАНИЗМ и ПРИРОДА ОБРАЗОВАНИЯ
КОВАЛЕНТНОЙ СВЯЗИ
Г. Льюис[16] первым выдвинул догадку о природе ковалентной[17] связи в 1916 г., предположив, что такая св