В пробирку налить 1–2 мл концентрированного раствора щелочи и опустить в том направлении алюминиевую проволоку. Приблизительно через 60 секунд оксидная пленка растворится, по окончании чего ополоснуть проволоку водой и поместить в раствор нитрата ртути. Алюминий как более деятельный металл вытесняет ртуть и образует с ней смесь (сплав алюминия с ртутью), мешающую происхождению защитной пленки на поверхности алюминия.
Амальгамированный алюминий ополоснуть водой и оставить на воздухе. Через некое время замечать образование продукта коррозии – рыхлых хлопьев гидроксида алюминия.
Требования к итогам опыта
1. Написать уравнение реакции сотрудничества алюминия с Hg(NO3)2.
2. Составить схему гальванопары (металлы – Al, Hg, электролит – Н2О, О2), написать уравнения анодного и катодного процессов и токообразующей реакции. Указать продукт коррозии алюминия.
3. Сделать вывод о роли защитной пленки в ослаблении коррозии.
Опыт 3. Защитные особенности железных покрытий
Налить в пробирку 2–3 мл раствора сульфата железа (II) и прибавить пара капель гексацианоферрата (III) калия, что есть реактивом на катион Fe2+. Замечать образование светло синий осадка КFe[Fe(CN)6].
В две пробирки налить по 2–3 мл раствора серной кислоты и по две капли раствора K3[Fe(CN)6]. В одну из пробирок опустить полосу оцинкованного железа, в другую – луженого железа. Через пара мин. в одной из пробирок (какой?) отмечается интенсивное светло синий окрашивание.
Требования к итогам опыта
1. Составить уравнение качественной реакции на ион Fe2+:
FeSO4 + К3[Fe(CN)6] =… .
2. Составить схемы образующихся гальванопар (Fe – Zn; Fe – Sn) в кислой среде и написать уравнения электродных и токообразующих реакций.
3. Сделать вывод, какой металл разрушается при нарушения анодного и катодного покрытия.
Примеры ответа задач
В узлах кристаллической решетки металлов расположены атомы и положительно заряженные ионы. Между узлами перемещаются валентные электроны. Эти электроны не имеют связи с отдельными ионами, а являются неспециализированными, принадлежащими всем ионам металла.
В случае, если загрузить металл в воду либо раствор его соли, то часть ионов металла, находящихся на поверхности, взаимодействует с полярными молекулами воды и переходит в раствор в виде гидратированных ионов. Благодаря этого раствор вблизи поверхности металла заряжается положительно, а на самом металле создается избыток электронов, придающих металлу отрицательный заряд.
Так, на границе металл – раствор образуется двойной электрический слой и появляется определенный скачок потенциала. Разность потенциалов, которая появляется на границе металл – раствор, именуется электродным потенциалом. Полное значение электродного потенциала измерить нереально. Исходя из этого электродные потенциалы определяют довольно стандартного водородного электрода, потенциал которого условно принят за ноль.
Разность потенциалов между металлом, загружённым в раствор собственной соли с концентрацией ионов металла 1 моль/л, и стандартным водородным электродом именуется стандартным электродным потенциалом металла. Обозначается j0, измеряется в вольтах (В). Значения некоторых стандартных электродных потенциалов приведены в табл. Б.4.
Расположенные в порядке повышения стандартного электродного потенциала металлы образуют последовательность напряжений металлов. Положение металла в последовательности напряжений определяет относительную окислительно-восстановительную свойство металла и его ионов. Чем меньшее значение имеет обычный электродный потенциал металла, тем более сильным восстановителем он есть. Чем больше потенциал железного электрода, тем более высокой окислительной свойством владеют его ионы. Любой металл способен вытеснять из растворов солей лишь те металлы, каковые имеют большее значение электродного потенциала – более деятельный металл замещает менее деятельный.
Последовательность металлов в последовательности напряжений сохраняется лишь для стандартной температуры (25 °С) и концентрации ионов металла в растворе 1 моль/л. При вторых концентрациях электролита электродный потенциал рассчитывается по уравнению Нернста:
j = j°+ 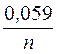 lg C,
lg C,
где j° ? обычный электродный потенциал, n – число электронов, участвующих в электродной реакции; C – концентрация ионов металла в растворе, моль/л.
В случае, если два электрода, загружённые в растворы электролитов, соединить железным проводником, образуется гальванический элемент. Гальваническими элементаминазывают устройства, в которых химическая энергия окислительно-восстановительных процессов преобразуется в электрическую энергию.
Так, реакция CuSO4 + Zn = Cu + ZnSO4 в электрохимическом варианте есть базой гальванического элемента Даниэля – Якоби, схема которого
(–) Zn | ZnSO4 || CuSO4 |Cu (+)
отражает совокупность обозначений для гальванических элементов. Слева записывается анод Zn | Zn2+ – электрод, имеющий меньшее значение электродного потенциала, отрицательный полюс (–), на нем протекает процесс окисления – анодная реакция: Zn –2e = Zn2+. Справа – катод Cu2+| Cu – электрод, имеющий большее значение электродного потенциала, хороший полюс (+), на нем протекает процесс восстановления – катодная реакция: Cu2+ + 2e = Cu. Одна вертикальная черта изображает фазовый раздел между раствором электролита и металлом. Двойная вертикальная линия отделяет анодное и катодное пространство.
Суммарная реакция, протекающая в гальваническом элементе, именуется токообразующей. При элемента Даниэля – Якоби токообразующая реакция имеет форму
Cu2+ + Zn = Cu + Zn2+.
Большая разность потенциалов электродов, которая возможно взята при работе гальванического элемента, именуется электродвижущей силой(ЭДС). Обозначается E, измеряется в вольтах. ЭДС элемента равна анода потенциалов и разности катода:
E = j к – j а.
Стандартная ЭДС равна разности стандартных электродных анода и потенциалов катода: E° = j°к– j°а Так, для элемента Даниэля – Якоби стандартная ЭДС равна E° = j°Сu2+/Cu – j°Zn2+/Zn = +0,337 – (–0,763) = +1,100 В.
Окислительно-восстановительная реакция, характеризующая работу гальванического элемента, протекает в направлении, в котором ЭДС имеет хорошее значение. В этом случае DG°х.р. 0, так как энергия Гиббса химической реакции и ЭДС связаны соотношением
DG° = – nE°F,
где n – число электронов, участвующих в электродной реакции; F – постоянная Фарадея, равная 96500 Кл; E° – стандартная ЭДС.
Гальванический элемент, складывающийся из двух электродов одного и того же металла, загружённых в растворы его соли различной концентрации, представляет собой концентрационный элемент. В этом случае электрод, загружённый в раствор электролита с меньшей концентрацией ионов металла, будет анодом. В качестве катода будет выступать электрод, опущенный в электролит с большей концентрацией ионов металла.
Пример 12.1.Выяснить ЭДС концентрационного серебряного элемента с концентрациями ионов Ag, равными 10–1 моль/л у одного электрода и
10-4 моль/л у другого при 298 К.
Ответ.Схема для того чтобы гальванического элемента Ag½Ag+||Ag+½Ag. По уравнению Нернста рассчитываем потенциалы двух серебряных электродов.
Для первого электрода
j Ag+/Ag = j°Ag+/Ag + 0,059 lg10-1 = 0,799 + 0,059?(–1) = 0,74 В.
Для второго электрода
j Ag+/Ag = j°Ag+/Ag + 0,059 lg10-4 = 0,799 + 0,059?(–4) = 0,563 В.
Первый электрод с громадным значением потенциала в данном элементе есть катодом, второй – анодом. ЭДС рассчитываем по формуле
E = j к – j а = 0,74 – 0,563 = 0,177 В.
Пример 12.2. Вычислить ЭДС элемента Cd½Cd2+ || Ni2+½Ni при концентрации ионов Cd2+ и Ni2+, равных соответственно 0,1 и 0,001 моль/л.
Ответ.Применяя уравнения Нернста и эти таблицы стандартных электродных потенциалов, рассчитываем электродные потенциалы Cd и Ni:
j Сd2+/Cd = j° Сd2+/Cd + 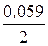 lg10-3 = –0,403 + 0,0295?(–3) = –0,4915 В;
lg10-3 = –0,403 + 0,0295?(–3) = –0,4915 В;
j Ni2+/Ni = j°Ni2+/Ni + 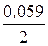 lg10-1 = –0,250 + 0,0295?(–1) = –0,2795 В.
lg10-1 = –0,250 + 0,0295?(–1) = –0,2795 В.
Так как j Сd2+/Cd j Ni2+/Ni , то токообразующей в этом гальваническом элементе есть реакция Cd0 + Ni2+ = Cd2+ + Ni0. Рассчитываем ЭДС элемента
E = j Ni2+/Ni – j Сd2+/Cd = –0,2795 – (–0,4915) = 0,212 В.
Пример 12.3. Исходя из значений стандартных электродных потенциалов и DG°х.р., указать, возможно ли в гальваническом элементе осуществить реакцию Pb2+ + Ti = Pb + Ti2+. Составить схему гальванического элемента, написать уравнения электродных реакций.
Ответ. В соответствии с уравнением реакции схему гальванического элемента возможно представить следующим образом:
(–) Ti½Ti2+|| Pb2+½Pb (+).
Уравнения электродных реакций имеют вид:
на аноде Ti0 – 2e ® Ti2+
на катоде Pb2++ 2e ® Pb0
Рассчитываем стандартное значение ЭДС:
E° = j°к – j°а = j° Pb2+/Pb – j° Ti2+/Ti = –0,126 – (–1,628) = 1,502 B.
Энергию Гиббса рассчитываем по уравнению DG = –nE°F = –2?1,502?96500 = = –289,9 кДж. Так как DG° 0, токообразующая реакция вероятна.
Пример 12.4. Как изменится масса цинковой пластинки при сотрудничестве ее с растворами: а) CuSO4; б) MgSO4; в) Pb(NO3)2? По какой причине? Составить молекулярные и ионные уравнения соответствующих реакций.
Ответ. В соответствии со значениями стандартных электродных потенциалов ионы Cu и свинца по отношению к цинку будут проявлять окислительную активность. При взаимодействии с растворами CuSO4 и Pb(NO3)2 будут протекать осаждения растворения и реакции цинка соответствующего металла:
а) CuSO4 + Zn = Cu + ZnSO4, Cu2+ + Zn = Cu + Zn2+;
б) Pb(NO3)2 + Zn = Pb + Zn(NO3)2, Pb2+ + Zn = Pb + Zn2+.
Один моль эквивалентов цинка (32,69 г/моль) будет замещаться на один моль эквивалентов меди (31,77 г/моль) либо свинца (103,6 г/моль). Учитывая молярные веса эквивалентов этих элементов, в растворе CuSO4 масса цинковой пластины будет незначительно уменьшаться, а в растворе Pb(NO3)2 – заметно возрастать.
Обычный потенциал магния имеет меньшее значение, чем потенциал цинка. Это указывает, что ионы магния не смогут окислять цинковую пластинку. Поведение цинка в таком растворе подобно окислению цинковой пластинки в воде: Zn – 2e = Zn2+. Протекание для того чтобы процесса приведет к малозаметному понижению массы цинковой пластинки.
Пример 12.5.Как происходит коррозия цинка, находящегося в контакте с кадмием, во мокром воздухе и в кислом растворе (НСl)? Составить уравнения анодного и катодного процессов. Привести схемы образующихся наряду с этим гальванических элементов. Выяснить состав продуктов коррозии.
Ответ.Цинк имеет меньшее значение потенциала (–0,763 В), чем кадмий
(–0,403 В), исходя из этого он есть анодом, а кадмий – катодом. Следовательно, цинк растворяется, а на поверхности кадмия идет восстановление: в кислом растворе – ионов водорода, во мокром воздухе – растворенного в воде кислорода.
Анодный процесс Zn – 2e = Zn2+.
Катодный процесс 2Н+ + 2e ® Н2 (в кислом растворе);
О2 + 2Н2О + 4e ® 4ОН– (во мокром воздухе).
Схема образующегося гальванического элемента во мокром воздухе:
(–) Zn | O2, H2O½Cd (+).
Схема образующегося гальванического элемента в кислом растворе:
(–) Zn½HCl½Cd (+).
Во мокром воздухе ионы Zn2+ с гидроксильными группами, выделяющимися на катоде, образуют малорастворимый гидроксид цинка Zn(ОН)2, что и есть продуктом коррозии.
В кислой среде на поверхности кадмия выделяется газообразный водород. В раствор переходят ионы Zn2+.
Пример 12.6. Хром находится в контакте с медью. Какой из металлов будет окисляться при коррозии, в случае, если эта пара металлов попадает в кислую среду (HCl)? Привести уравнения анодного и катодного процессов, схему образующегося гальванического элемента. Каков состав продуктов коррозии?
Ответ.По положению в последовательности напряжений металлов видно, что хром более деятельный металл (j°Сr3+/Cr = –0,744 В), чем медь (j°Сu2+/Cu = 0,337 В). В образованной гальванической паре Cr – анод, он окисляется, а Cu – катод, на ее поверхности выделяется (восстанавливается) водород из HCl.
Анодный процесс: Cr –3e = Cr3+
Катодный процесс в кислой среде: 2Н+ + 2e ® Н2
Схема гальванического элемента: (–) Cr½HCl½Cu (+)
Появляющиеся ионы Cr3+ образуют с хлорид-анионами (из HCl) растворимое соединение – CrC13, на поверхности меди выделяется Н2.
упражнения и Задачи для независимого ответа
12.1. а). Чему равна величина ЭДС гальванического элемента, составленного из стандартных цинкового и серебряного электродов, загружённых в растворы их солей? Привести схему реакции и гальванического элемента, протекающие на электродах при его работе. (Ответ: 1,562 В).
б). Вероятна ли электрохимическая коррозия алюминия, контактирующего со свинцом в нейтральном водном растворе, содержащем растворенный кислород? В случае, если да, то написать уравнения реакций анодного и катодного процессов. Составить схему образующегося гальванического элемента.
12.2. а). Чему равна величина ЭДС цинкового концентрационного элемента, составленного из двух цинковых электродов, опущенных в растворы с концентрациями ионов Zn2+, равными 10–2 и 10–6 моль/л? Привести схему реакции и такого элемента, протекающие на электродах при его работе.
(Ответ: 0,118 В).
б). Как происходит атмосферная коррозия луженого и оцинкованного железа при нарушении покрытия? Составить уравнения анодного и катодного процессов. Привести схемы образующихся гальванических элементов.
12.3. а). Имеется гальванический элемент, в котором протекает токообразующая реакция Ni + Cu2+ = Cu + Ni2+. Привести схему для того чтобы элемента, написать уравнения электродных процессов.
б). Изделие из алюминия склепано с медью. Какой из металлов будет подвергаться коррозии, в случае, если эти металлы попадут в кислую среду (HCl)? Составить уравнения происходящих наряду с этим процессов, привести схему образующегося гальванического элемента. Выяснить продукты коррозии.
12.4. а). Составить схему, написать уравнения токообразующей и электродных реакций для гальванического элемента, у которого один из электродов кобальтовый (СCо2+ = 10–1 моль/л), а второй – обычный водородный. Вычислить ЭДС элемента при 298 К. Как изменится ЭДС, в случае, если концентрация ионов Со2+ уменьшить на порядок? (Ответ: 0,307 В; 0,336 В).
б). Составить уравнения анодного и катодного процессов при коррозии пары магний – свинец в кислой среде и во мокром воздухе. Какие конкретно продукты коррозии образуются в первом и во втором случаях?
12.5. а).Каково значение ЭДС элемента, складывающегося из бронзового и свинцового электродов, загружённых в растворы солей этих металлов с концентрациями их ионов 1 моль/л? Изменится либо нет ЭДС этого элемента и по какой причине, в случае, если концентрации ионов металлов будут составлять 0,001 моль/л? Составить уравнения электродных и токообразующей реакций. Привести схему гальванического элемента. (Ответ: 0,463 В).
б). Привести по одному примеру катодного и анодного покрытия для кобальта. Составить уравнения катодных и анодных процессов во мокром воздухе и в растворе соляной кислоты при нарушении целостности покрытия.
12.6. а). Составить схему, привести уравнения электродных процессов и вычислить ЭДС концентрационного гальванического элемента, складывающегося из бронзовых электродов, опущенных в растворы СuSO4 с концентрациями 0,01 и 0,1 моль/л. (Ответ: 0,0295 В).
б).К какому типу покрытий относятся олово на меди и на железе? Какие конкретно процессы будут протекать при атмосферной коррозии указанных пар в нейтральной среде? Написатьуравнения катодных и анодных реакций.
12.7. а).По окончании нахождения в растворах каких из приведенных солей масса кадмиевой пластинки увеличится либо уменьшится: а) MgCl2; б) Hg(NO3)2; в) CuSO4; г) AgNO3; д) CaCl2? Ответ обосновать.
б). Бронзовое изделие покрыли серебром. К какому типу относится такое покрытие – к анодному либо катодному? Составить уравнения электродных процессов коррозии этого изделия при нарушении целостности покрытия во мокром воздухе и в растворе соляной кислоты. Привести схемы образующихся наряду с этим гальванических элементов.
12.8. а). Составить схему, привести уравнения электродных процессов и вычислить ЭДС гальванического элемента, складывающегося из свинцовой и магниевой пластин, каковые опущены в растворы собственных солей с концентрацией ионов Pb2+ и Mg2+, равных 1 моль/л. Изменится ли значение ЭДС, в случае, если концентрацию каждого из ионов понизить в 100 раз? Ответ обосновать. (Ответ: 2,237 В).
б). В воду, содержащую растворенный кислород, опустили никелевую и никелевую пластинку , частично покрытую медью. В каком случае процесс коррозии никеля происходит интенсивнее? По какой причине? Составить уравнения анодного и катодного процессов для пластинки покрытой медью.
12.9. а).В два сосуда с голубым раствором сульфата меди поместили в первоначальный хромовую пластинку, а во второй платиновую. В каком сосуде цвет раствора понемногу исчезает? По какой причине? Составить электронные и молекулярные уравнения соответствующих реакций.
б). Какой металл целесообразнее выбрать для протекторной защиты металлического изделия: цинк, никель либо кобальт? По какой причине? Составить уравнения анодного и катодного процессов атмосферной коррозии таких изделий. Каков состав продуктов коррозии?
12.10. а). Составить схемы двух гальванических элементов, в одном из которых оловянная пластинка была бы катодом, а в другом анодом. Написать для каждого из этих элементов уравнения электродных (катодных и анодных) процессов и токообразующих реакций.
б). Железо покрыто хромом. Какой из металлов будет корродировать при нарушения поверхностного слоя покрытия при атмосферной коррозии? Какое это покрытие катодное либо анодное? Составить схему процессов, происходящих на электродах образующегося гальванического элемента.
12.11. а). Составить схему гальванического элемента, в базе работы которого лежит реакция: Ni + Pb(NO3)2 = Ni(NO3)2 + Pb. Написать уравнения электродных (катодных и анодных) процессов. Вычислить ЭДС этого элемента, в случае, если СNi2+ = 0,01 моль/л, а СPb2+ = 0,0001 моль/л. (Ответ: 0,065 В).
б). Вычислить энергию Гиббса реакции 2Ме + 2Н2О (ж) + О2 = 2Ме(ОН)2
и выяснить, какой из металлов – магний либо медь, интенсивнее будет корродировать во мокром воздухе. Стандартные энергии Гиббса образования D¦G° Mg(OH)2, Cu(OH)2, H2O (ж) соответственно равны –833,7;
–356,9; –237,3 кДж/моль.
12.12. а). Вычислить электродный потенциал цинка в растворе ZnCl2, в котором концентрация Zn2+ образовывает 0,1 моль/л. Как изменится значение потенциала при разбавлении раствора в 100 раз? (Ответ: –0,79 В; –0,85 В).
б). Какой из металлов – алюминий либо золото, будет подвергаться коррозии во мокром воздухе по уравнению: 4Ме + 6Н2О (ж) + 3О2 = 4Ме(ОН)3.
Ответ обосновать, вычислив энергию Гиббса реакции. Стандартные энергии Гиббса образования D¦G° Al(OH)3, Au(OH)3, H2O (ж) соответственно равны
–1139,7; –289,9; –237,3 кДж/моль.
12.13. а). Составить схему гальванического элемента, электродами в котором помогают пластинки из меди и олова. Исходя из размеров стандартных электродных потенциалов, вычислить значения Е° и DG°. Выяснить направление протекания токообразующей реакции. (Ответ: 0,473 В; –91,3 кДж).
б).Какие конкретно из перечисленных металлов смогут быть использованы для протекторной защиты металлического изделия в присутствии электролита, содержащего растворенный кислород в нейтральной среде: алюминий, хром, серебро, кадмий? Привести уравнения анодного и катодного процессов атмосферной коррозии таких изделий. Каков состав продуктов коррозии?
12.14. а). Составить схему гальванического элемента, образованного свинцом и железом, загружёнными в растворы их солей с концентрациями ионов металлов 0,01 моль/л. Привести уравнения токообразующих электродных процессов и реакций. Вычислить ЭДС. (Ответ: 0,314 В).
б). Изделие из хрома спаяно свинцом. Какой из металлов будет корродировать при попадании для того чтобы изделия в кислотную среду (HCl)? Привести уравнения анодного и катодного процессов и образующиеся продукты коррозии.
12.15. а). Исходя из размеров стандартных электродных потенциалов, вычислить значения ЭДС и DG° и выяснить, будет ли трудиться гальванический элемент, в котором на электродах протекают реакции:
Hg0 – 2e = Hg2+,
Pb2+ + 2e = Pb0.
(Ответ: –0,98 В; +189,1 кДж).
б). Составить уравнения анодного и катодного процессов, происходящих при коррозии железа, покрытого серебром, во мокром воздухе и в кислой среде. Выяснить тип покрытия – анодное либо катодное? Какие конкретно продукты образуются в следствии коррозии?
12.16. а). Исходя из размеров стандартных электродных потенциалов, вычислить значения ЭДС и DG° и сделать вывод о возможности протекания реакции Cu + 2Ag+ Cu2+ + 2Ag в прямом направлении.
(Ответ: 0,462 В; –89,2 кДж).
б). Какие конкретно металлы смогут быть использованы в качестве анодного покрытия сплава Zn – Cd? Привести уравнения анодного и катодного процессов при коррозии для того чтобы сплава во мокром воздухе в отсутствие анодного покрытия.
12.17. а). Как изменится масса хромовой пластинки по окончании нахождения в растворах солей: а) CuSO4; б) MgCl2; в) AgNO3; г) CaCl2? Ответ обосновать.
б). Привести уравнения анодного и катодного процессов при коррозии сплава Fe – Sn во мокром воздухе и в кислой среде. Выяснить продукты коррозии.
12.18. а). Составить схемы двух гальванических элементов, в одном из которых цинк – отрицательный электрод, а в другом – хороший. Привести уравнения токообразующих электродных процессов и реакций.
б). Привести уравнения анодного и катодного процессов, происходящих при коррозии сплава Al – Ni в воздухе мокрого воздуха и в кислой среде (НС1). Выяснить продукты коррозии.
12.19. а). Электродные потенциалы серебра и железа соответственно равны –0,44 и +0,799 В. Какая реакция самопроизвольно протекает в железо-серебряном гальваническом элементе
Fe0 + 2Ag+ = Fe2+ + 2Ag0 либо 2Ag0 + Fe2+ = Fe0 + 2Ag+?
Ответ обосновать, вычислив энергию Гиббса каждой из приведенных реакций.
б). пластинку и Хромовую пластинку из хрома, частично покрытую серебром, поместили в раствор соляной кислоты. В каком случае процесс коррозии хрома протекает более интенсивно? По какой причине? Привести уравнения соответствующих процессов.
12.20. а). Вычислить ЭДС гальванического элемента, складывающегося из водородного электрода, опущенного в чистую воду, и оловянного электрода, опущенного в раствор с концентрацией ионов олова (II) 1 моль/л. (Ответ: 0,16 В).
б). Составить уравнения самопроизвольно протекающих реакций при олова и атмосферной коррозии цинка, находящихся в контакте. Привести схему образующегося гальванического элемента.
Лабораторная работа 13
Электролиз
Цель работы: изучить понятие «электролиз», разглядеть анодные и катодные процессы при электролизе растворов разных солей.
Задание: совершить электролиз водных растворов солей. Выполнить требования к итогам опытов, оформить отчет, решить задачу.
Теоретическое введение
Электролизом именуется совокупность процессов, протекающих при прохождении постоянного электрического тока через электрохимическую совокупность, складывающуюся из двух расплава и электродов либо раствора электролита.
В случае, если в раствор электролита загрузить электроды и подключить их к внешнему источнику постоянного тока, то ионы в растворе приобретают направленное перемещение. К аноду (хорошему электроду) движутся анионы (кислотные остатки, OH?). К катоду (отрицательному электроду) движутся катионы (Мn+, H+). Достигнув электродов, ионы разряжаются: у анода восстановитель отдает электроны (в сеть) и окисляется; у катода окислитель присоединяет электроны (из сети) и восстанавливается.
При электролизе водных растворов, не считая ионов электролита в окислительно-восстановительном ходе принимают участие молекулы воды. Молекулы воды очень сильно полярны и исходя из этого притягиваются и к катоду и к аноду. На катоде молекулы воды смогут восстанавливаться:
2Н2О + 2e = Н2 + 2ОН– (j = –0,41 В),
а на аноде – окисляться:
2Н2О – 4e = 4Н+ + О2 (j = +1,23 В).
Темперамент катодного процесса при электролизе водных растворов определяется величиной стандартного электродного потенциала металла. На катоде первым делом восстанавливаются катионы, имеющие громаднейшее значение электродного потенциала. В случае, если катионом электролита есть металл, электродный потенциал которого намного более отрицательный, чем –0,41 В, то на катоде металл восстанавливаться не будет, а случится восстановление молекул воды. Эти металлы находятся в последовательности напряжений от Li по Al включительно. В случае, если катионом электролита есть металл, электродный потенциал которого существенно лучше, чем –0,41 В, то из нейтрального раствора для того чтобы электролита на катоде будет восстанавливаться металл. Такие металлы находятся в последовательности напряжений вблизи водорода (приблизительно от олова и по окончании него). При ионов металлов, имеющих значения потенциала родные к –0,41 В (Zn, Cr, Fe, Cd, Ni), в зависимости от условий электролиза и концентрации электролита, допустимо как восстановление металла, так и выделение водорода, а часто и их совместный разряд.
На аноде первым делом окисляются анионы с мельчайшим значением электродного потенциала. Различают электролиз с нерастворимым (инертным) и растворимым (активным) анодами. Инертным именуется анод, материал которого на протяжении электролиза не окисляется (графит, уголь, платина). Активным именуется анод, материал которого может окисляться на протяжении электролиза.
На инертном аноде при электролизе водных растворов щелочей, растворов электролитов с кислородсодержащими анионами (SO42?, PO43?, NO3?), и фторид-ионами F? на аноде происходит электрохимическое окисление воды:
2H2O ? 4e 4H+ + O2.
В случае, если анионы электролита бескислородны (Cl?, Br?, I?, S2?), то они и разряжаются на аноде на протяжении электролиза.
Деятельный (растворимый) анод при электролизе окисляется – переходит в раствор в виде ионов.
Разглядим пара случаев электролиза водных растворов солей.
Э л е к т р о л и з р а с т в о р а CuCl2 c и н е р т н ы м а н о д о м
Электродный потенциал меди (+0,337 В) намного больше потенциала восстановления ионов водорода из воды (–0,41 В). Исходя из этого на катоде происходит процесс восстановления ионов Cu2+. У анода будут окисляться хлорид-ионы.
Схема электролиза раствора хлорида меди (II)
CuCl2 = Cu2+ + 2Cl?
Катод (?) Cu2+, H2O Анод (+) Cl?, H2O
Cu2+ + 2e Cu0 2Cl? ? 2e Cl2
Суммарное уравнение реакции, протекающей при электролизе, имеет форму:
CuCl2 Cu + Cl2.
Продукты электролиза – Cu и Cl2.
Э л е к т р о л и з р а с т в о р а KNO3 с и н е р т н ы м а н о д о м
Электродный потенциал калия (?2,924 В) намного меньше потенциала восстановления ионов водорода из воды (–0,41 В), исходя из этого катионы K+ не будут восстанавливаться на катоде. Кислородсодержащие анионы NO3? не будут окисляться на аноде. В этом случае на аноде и катоде восстанавливаются и окисляются молекулы воды. Наряду с этим в катодном пространстве будут накапливаться ионы OH?, образующие с ионами K+ щелочь KOH, а в анодном пространстве накапливаются ионы H+, образующие с ионами NO3? кислоту HNO3.
Схема электролиза раствора нитрата калия
KNO3 = K+ + NO3?
Катод (?) K+, H2O Анод (+) NO3?, H2O
2H2O + 2e H2 + 2OH?; 2H2O ? 4e O2 + 4H+;
у катода 2K+ + 2OH? 2KOH; у анода 2H+ + 2NO3? 2HNO3.
Суммарное уравнение реакции электролиза раствора KNO3
2KNO3 + 4H2O 2H2 + О2 + 2КОН + 2HNO3.
Продукты электролиза – Н2 и О2. У катода образуется щелочь КОН
(рН 7); у анода ? кислота HNO3 и рН 7.
Э л е к т р о л и з р а с т в о р а NiSO4 с н и к е л е в ы м а н о д о м
В этом случае сам анод окисляется, а на катоде восстанавливаются ионы никеля.
Схема электролиза раствора сульфата никеля
Катод (?) Ni2+, H2O Анод никелевый SO42?, H2O
Ni2+ + 2e Ni0 Ni0 – 2e Ni2+
Исполнение работы