1.1 Цель работы – ознакомиться с способами изучения объектов экологии (воздуха, земли, вторых природных и техногенных сред, пищевых продуктов), каковые нужны при санитарно-гигиенических и экологических изучениях, при контроле качества экологии, соответствия ее гигиеническим нормативам, снабжающим здоровья условий человека и безопасность труда.
Задание.
1. Осуществить посев на МПА микроорганизмов воздуха лабораторных коридора и помещений способом оседания.
2. Осуществить глубинный посев на МПА разных разведений земли (от 10-2 до 10-6г).
3. Осуществить посев пищевых продуктов плотной консистенции на МПА
Устройства, посуда, реактивы.
Стерильная посуда, стерильный МПА, разлитый в пробирки; колбочки со 100 мл стерильной воды; стерильная вода, разлитая в пробирки по 9 мл, 10%-ный стерильный бикарбонат натрия, стерильные пипетки, спиртовка, шпатели, часовые стекла, 96%-ный этиловый спирт; земля, продукты питания.
Посев микроорганизмов воздуха.
В окружающем воздухе содержится масса сапрофитных и патогенных микроорганизмов, попадающих в него с пылью, выдыхаемых при дыхании, кашле беседе. Для микробиологического изучения воздуха пользуются способами, в базу которых положены оседание (седиментация) и аспирация.
Движение работы Подготовленную чашку Петри развертывают и оставляют в той бумаге, в которой она была стерилизована. Выполняя стерильность, разогретый МПА разливают в чашки Петри. Для обеспечения стерильности разлив создают около пламени спиртовки в радиусе 10-15 см от ее центра. Горло пробирки обжигают в пламени спиртовки. Свободными пальцами левой руки приоткрывают чашку Петри кроме этого в сторону пламени и выливают в нее питательную среду из пробирки. Вращая чашку Петри по поверхности стола, агар равномерно распределяют по дну чашки и дают пластине остановиться. На крышке чашки Петри карандашом по стеку показывают вариант опыта, дату посева, фамилию.
Для заражения чашки Петри открывают в исследуемом помещении на 5-20 мин. в зависимости от предполагаемого загрязнения воздуха Крышку чашки Петри снимают и, не переворачивая, ставят рядом. После этого чашку Петри ставят в термостат при 370С.
Посев микроорганизмов земли.
Земля есть самая благоприятной средой для развития микроорганизмов. В связи с громадной неоднородностью ее состава, для учета численности микроорганизмов в ней с исследуемого участка берут среднюю почвенную пробу.
Движение работы. Для определения численности бактерий сперва готовят суспензию (способом разведения), содержащую различные концентрации земли в 1 мл воды. Для этого на стерильное часовое стекло стерильным фарфоровым шпателем либо алюминиевой ложкой берут из банки либо мешка навеску земли в 1 г. Часовое стекло, шпатель, ложку обжигают в пламени горелки либо фламбируют горящим спиртом. Дабы при взвешивании земли в нее не попали бактерии из воздуха, часовое стекло накрывают вторым стерильным часовым стеклом.
Навеску земли, выполняя условия асептики, переносят в колбу на 250 мл со 100 мл стерильной воды. Смесь взбалтывают 5 мин., не смачивая пробку. Стерильной пипеткой берут 1 мл суспензии, содержащей 10-2 г земли, и переносят в пробирку с 9 мл стерильной водопроводной воды. Пипетку много раз промывают водой в пробирке, дабы максимально смыть клетки с ее стены. Второй стерильной пипеткой берут из колбы еще 1 мл суспензии и помещают во вторую колбу, также содержащую 100 мл стерильной водопроводной воды. Эту пипетку промывают равно как и в первом случае. вторую колбу и Пробирку взбалтывают 1 60 секунд: в пробирке будет концентрация 10-3 г, а во второй колбе – 10-4 г. Совершенно верно так же новыми стерильными пипетками переносят по 1 мл суспензии из второй колбы во вторую пробирку с 9 мл и в третью колбу со 100 мл стерильной водопроводной воды и готовят новые суспензии. Которые содержат соответственно в 1 мл 10-5 и 10-6 г земли.
Для определения численности бактерий в каждом разведении способом питательных пластин возможно совершить глубинный либо поверхностный посев. Последний метод более сложен и занимает больше времени. Для определения живых клеток, содержащихся в 1 мл суспензии каждого разведения, берут 1 мл суспензии из каждого разведения и переносят в стерильную чашку Петри, применяя любой раз новую стерильную пипетку. На крышках чашек Петри карандашом по стеклу отмечают землю, разведение, фамилию студента. После этого в них вливают расплавленный МПА, заблаговременно приготовленный и разлитый по 20 мл в громадные пробирки из расчета одна пробирка на одну чашку. Температура агара должна быть приблизительно 450С. Ее устанавливают следующим образом: пробирку с расплавленным агаром прикладывают к щеке, в случае, если щека выдерживает эту температуру, то массу возможно выливать в чашку Петри.
С опаской круговым перемещением чашки, не смачивая крышку, агар перемешивают с суспензией. Чашки с застывшим агаром переворачивают вверх дном, дабы избежать попадания на поверхность агара конденсированной воды с крышки, и помещают в термостат при 28-300С.
Клетки микроорганизмов в питательной среде начинают деятельно размножаться и образуют колонии, видимые невооруженным глазом на пять дня.
Посев пищевых продуктов
Порядок взятия проб, способы их изучения и нормативы качества регламентируются серией ГОСТ либо второй нормативно-технической документацией.
Исходным материалом для посева продуктов плотной консистенции в большинстве случаев есть 10%-ная взвесь продукта.
Движение работыДля изготовление 10%-ной взвеси продукта забранную из различных мест навеску (в большинстве случаев около 15 г) измельчают в гомогенизаторе (либо растирают в стерильной ступке), прибавляют 136 мл водопроводной воды либо изотонического раствора хлорида натрия. Жидкие и полужидкие продукты шепетильно перемешивают и при быстро кислой реакции подщелачивают 10%-ным стерильным бикарбонатом натрия до pH 7,2-7,4. Жидкий продукт либо взятую взвесь плотного продукта применяют для того чтобы десятикратных разведений в зависимости от характера продукта и от предполагаемого обсеменения
2 Контрольные вопросы
1)По какой причине при посеве микроорганизмов земли готовят пара разведений?
2) Какая из сред обитания, земля, воздушное пространство либо вода являются самая благоприятной для существования микроорганизмов?
Лабораторная работа № 8
Анализ посевов воздуха, земли и пищевых продуктов
1.1 Цель работы –совершить количественный и качественный учет микрофлоры земли, воздуха и пищевых продуктов.
Задание
1. Осуществить количественный учет микрофлоры воздуха лабораторных коридора и помещений, подсчитывая число колоний, выросших на МПА, заполнить таблицу 1. Оценить качественный состав микроорганизмов воздуха. Приготовить препараты «раздавленная капля» главных групп микроорганизмов и заполнить таблицы 2 и 3. Микроскопировать и зарисовать.
2. Посчитать общее число микроорганизмов в 1 г земли, подсчитывая число колоний, выросших МПА. Обрисовать микробное разнообразие на основании изучения морфологических и культуральных показателей выросших колоний. Заполнить таблицу 2. Приготовить препараты «раздавленная капля» главных групп микроорганизмов. Микроскопировать и зарисовать.
3. Выяснить неспециализированную обсемененность 1 г пищевого продукта, учитывая количество колоний мезофильных микроорганизмов, выросших на мясо-пептонном агаре. Приготовить препараты «раздавленная капля» главных групп микроорганизмов. Микроскопировать и зарисовать.
Устройства, посуда, реактивы.
Спиртовка, бактериологические петли, препаровальные иглы, 96%-ный этиловый спирт, чашки Петри с посевами микроорганизмов земли, воздуха и пищевых продуктов.
Клетки микроорганизмов, попав в питательную среду, начинают размножаться и образуют видимые невооруженным глазом колонии.
Движение работы Количественный учет микроорганизмов воздуха. Учет посева бактерий из воздуха создают методом подсчета колонии бактерий на поверхности питательной среды. Зная площадь чашки Петри, возможно выяснить количество микроорганизмов в 1 м3 воздуха. Для этого:
1.Определяют площадь питательной среды в чашке по формуле ?r2;
2. Вычисляют количество колонии на площади 1 дм2;
3. Создают пересчет количества бактерий на 1 м3 воздуха.
Примерный расчет. В чашке Петри диаметром в 10 см выросло 25 колонии.
1. Определяют площадь питательной среды в чашке по формуле ?r2;
3,14 • r2 либо 3,14 • 25 = 78,5 см2 .
2. Вычисляют количество колонии на площади 1 дм2, равного 100 см2, по пропорции:
25 колонии – 78,5 см2
х колонии – 100 см2.
Х = 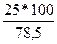 = 32 колонии,
= 32 колонии,
т.е. на площади 1 дм2 имеется 32 колонии.
3. Пересчитывают количество бактерий на 1 м3 воздуха, что равен 1000 л. 32 колонии бактерий на площади 1 дм2 соответствует количеству 10 л. воздуха. Дабы определить их количество в 1 м3, составляем пропорцию:
32-10
х-1000,
из этого Х = 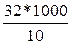 = 3200.
= 3200.
Следовательно, в 1 м3 воздуха содержится 3200 бактериальных телец.
После этого приступают к качественному анализу микрофлоры воздуха. Для этого выполняют описание колоний по внешней форме. Отдельные колонии микроскопируют.
Согласно расчетам, сравнивая результаты анализа воздуха разных помещений, определяют аудиторию с меньшей и большей загрязненностью воздуха. Все результаты последующих пересчётов и подсчёта колоний записывают в таблицу.
Таблица 1 Определение степени загрязненности воздуха различных аудиторий
| № аудитории | Кол-во микроорганизмов в 1м3 воздуха | Степень загрязненности воздуха | Главная форма (%) |
Качественный анализ микроорганизмов воздуха . Для определения качественного состава микрофлоры воздуха применяют две разные группы диагностических показателей: морфологические и культуральные, по которым нужно обрисовать господствующую форму и выяснить ее процент.
Показатели, замечаемые под микроскопом, относятся к показателям морфологического характера: форма бактериальной клетки (палочки, кокки, сарцины и др.), тип роста (единичные клетки, образуют цепочки), свойство к спорообразованию (форма спорообразования), подвижность, темперамент жгутикования, окраска по Грамму.
Для описания морфологических показателей нужно из главных колоний приготовить фиксированный окрашенный препарат и препарат живых микроорганизмов способом «раздавленная капля» и заполнить таблицу:
Таблица 2 Кое-какие особенности морфологии клеток микроорганизмов, выросших на МПА
| № колонии | Микроскопическая картина (рисунок) | Форма клеток | Сочетание клеток | Подвиж-ность | Наличие спор |
Культуральные показатели. Обрисовывают и зарисовывают преобладающие, и самые интересные колонии. Результаты наблюдений вносят в таблицу 3.
Таблица 3 Культуральные показатели микроорганизмов, выросших на МПА
| № колонии | Фор-ма | Диа-метр | Блеск, прозрач-ность | Цвет | Поверх-ность | Про-филь | Край | Струк-тура | Кон-сис-тен-ция | Флуо-рес-стоимостей=ция | Рис. Коло-нии |
самая существенной изюминкой роста микроорганизмов на плотной питательной среде есть темперамент колонии. Описание поверхности колонии выполняют по следующей схеме:
1. Форма колонии (округлая, неправильной формы, ризоидная и т.д.).
2. Поверхность колоний (ровная, шероховатая, бороздчатая, складчатая, морщинистая, с концентрическими кругами либо радиально исчерченная).
3. Профиль колонии (плоский, выпуклый, кратерообразный, конусовидный и т.д.)
4. прозрачность и Блеск (колония блестящая, матовая, тусклая, мучнистая, прозрачная и т. д.
5. Цвет колонии (бесцветная – грязно-белые колонии относят к бесцветным, либо пигментированная – белая, желтая, золотистая, оранжевая, сиреневая, красная, тёмная).
6. Размер (диаметр) колонии измеряется посредством простой линейкой либо окулярного микрометра при малом повышении микроскопа и показывают ее величину в мм. Чашки наряду с этим помещают на столик микроскопа крышками вниз. Точечными именуют колонии менее 1 мм в диаметре, но видимые невооруженным глазом. Небольшие колонии 1 – 2 мм, средние – 2 – 4 мм и большие – более 4 мм в диаметре.
7. Край колонии (ровный, волнистый, зубчатый, бахромчатый и т. д.) определяют при малом повышении микроскопа либо посредством лупы. Чашку помещают на столик микроскопа, как указано выше.
8. Структуру колонии (однородная, мелко – либо крупнозернистая, струйчатая т. д.) определяют при малом повышении микроскопа либо посредством лупы.
9. Консистенцию колонии определяют, прикасаясь к ее поверхности петлей. Колония может легко сниматься с агара, быть плотной, мягкой либо врастающей в агар, слизистой оболочке (прилипает к петле),тягучей, волокнистой (снимается полностью), хрупкой (легко ломается при прикосновении петлей).
Помимо этого, отмечают свойство колонии эмульгироваться – одни колонии образуют в физиологическом растворе гомогенную взвесь, у других взвесь зернистая либо в виде обрывков пленок.
Из каждой группы колонии, выросших на плотных средах, готовят препарат и определяют по форме клеток, к какому роду микроорганизмов они относятся. Из общего количества микроорганизмов, развивающихся на МПА, возможно выделить следующие роды:
Род Pseudomonas. На МПА образует колонии круглые, неправильной формы, плоские, выпуклые, слизистые и пастообразные, просвечивающие , бесцветные либо пигментированные (грязно-белые, светло синий, светло синий-зеленые, красные, желтые, бурые и тёмные). Характерная изюминка представителей этого рода – образование светло синий-зеленого либо желто-зеленого флуоресцирующего пигмента. Кое-какие колонии удается замечать лишь в ультрафиолетовых лучах. У других видов пигменты диффундируют в среду, окрашивая ее в соответствующий цвет. Образование определенного пигмента зависит от состава и рН среды.
Клетки Pseudomonas прямые либо изогнутые, довольно часто с заостренными финишами, но не спиральные. Они находятся одиночно, парами либо маленькими цепочками. Размеры клеток 0,5 –1 х 1,5 – 4 мкм. Движутся эти микробы посредством жгутиков (монотрихи либо лофотрихи), не образуют чехлов, для них малоизвестны стадии спокойствия. Значительно чаще они – аэробы, но кое-какие в анаэробных условиях смогут применять для дыхания нитраты. Клетки грамотрицательные.
Род Flavobacterium. Образуют на МПА колонии диаметром 2 – 3 мм, чаще ровные, матовые, прозрачные, желтого цвета за счет каротиноидных пигментов, не диффундирующих в среду, видятся желтовато- оранжевые колонии, время от времени и красные. Клетки палочковидной формы (0,25 – 0,3 х 4,0 мкм), легко искривленные, большая часть неподвижные (подвижные лишь перитрихи), расположены одиночно, время от времени парами и в виде маленьких цепочек, а время от времени в виде нити. Характерен защелкивающийся тип деления (снеппинг – тип обособления делящихся клеток). Грамотрицательные.
Род Micrococcus. Образуют на МПА, в большинстве случаев, колонии небольших и средних размеров (2 — 1 мм в диаметре). Колонии смогут быть матовыми, блестящими, маслянистыми; ровными, выпуклыми, плоскими; зернистыми, мелкоскладчатыми, пастообразной либо слизистой оболочке консистенции, время от времени видятся сухие плотные колонии; цвет колонии возможно белый, серый, реже бесцветный; видятся буроватые, желтовато-зеленые, розовые и красные. Пигменты в среду не диффундируют. Клетки небольшие (0,2 – 1,5 мкм в диаметре), одиночные и соединенные в пары, в ряд либо в виде бесформенных скоплений. Клетки неподвижны, не образуют эндоспор. Грамположительные.
Род Sarcina. Колонии средних размеров: круглые, компактные, выпуклые, плоские, ровные, бугристые либо складчатые, зернистой структуры; матовые либо жирно-блестящие; белые, желтые, лимонно-желтые, время от времени розовые, красные. Клетки сферические (1,8 – 3,0 мкм в диаметре), соединены в пакеты из 8 либо более клеток.
Род Mycobacterium. Относится к группе актиномицетов. На МПА растут медлительно. В начале образуют небольшие, круглые компактные колонии, время от времени немного поднятые, мягкие, пастообразной либо слизистой оболочке консистенции (растекающиеся по субстрату), бывают сухие крошащиеся; бугристые складчатые; матовые, блестящие, бесцветные либо окрашенные (красные, оранжевые, желтые, зеленые, светло синий, бурые, тёмные). Пигмент в среду не выделяют. Юные клетки ветвистые либо угловатые с неправильными контурами (3,0 – 7,0 х 0,7 мкм); с возрастом у многих видов клеток происходит распад на кокковидные и круглые образования. Обособление делящихся клеток происходит по снэппинг-типу. Большая часть видов грамположительные.
Род Bacillus. Палочковидные бактерии, талантливые образовать более либо менее термоустойчивые споры. На протяжении формирования споры сохраняется палочковидная форма либо отмечается маленькое ее утолщение. По характеру роста колоний на МПА (либо МПА + сусло-агар) возможно время от времени выяснить видовую принадлежность бацилл. Клетки грамположительные. Аэробы.
Bacillus subtilis – сенная палочка. Колонии сухие мелко морщинистые, бархатистые, бесцветные либо розовые, срастающиеся с агаром; край колонии волнистый либо легко волнистый. Палочки маленькие и узкие – 3 – 5 х 9 мкм. Споры круглые 0,9 х 0,6 мкм, расположены не строго центрально, но на некоторых средах ближе к центру. Клетки подвижные (перитрихи).
Bacillus megaterium – образуют колонии ровные; белые, выпуклые, жирно-блестящие, редко складчатые; края колонии быстро очерчены либо волнисто-бахромчатые. Споры круглые либо цилиндрические, не шире материнской клетки, в поперечнике достигают 2 мкм. Протяженность клеток 5 – 7 мкм.
Bacillus mesentericus — картофельная палочка. Колонии на МПА узкие, сухие, морщинистые, серовато-белые, не срастаются с субстратом. Палочки узкие, долгие и маленькие, подвижные (3 – 10 х 5 – 0,6 мкм), время от времени палочки соединены в долгие нити. Споры круглые и продолговатые формы (0,9 – 0,5 мкм). При формировании спор клетки не меняют палочковидной формы. Прорастание спор экваториальное.
Bacillus mycoides – грибовидная палочка. Образует колонии характерные: плоские, ризоидные либо мицеловидные, стелющиеся по поверхности агара. Пучки нитей отходят от края колонии, образуют фальшивое ветвление; нити изгибают направо либо налево, образуя право- либо левовращающиеся формы колонии. Клетки в поперечнике – 0,8 – 1,2 мкм, по длине в зависимости от среды – 5 – 7 мкм, но довольно часто 10 мкм и более. Цитоплазма вакуолизирована, с гранулами запасных питательных веществ, формы подвижные (перитрихи). Вид имеет довольно много вариантов. Клетки грамположительные.
Bacillus cereus – колоний толстые, компактные, матовые со складчатым центром и ризоидными волнистыми краями; время от времени мелкобугристые, с бахромчатыми краями, от которых отходят узкие сплетения нитей. Клетки толстые – 1,0 – 1,5 мкм в поперечнике и 3 – 5 мкм длины, время от времени дольше; одиночные и соединенные в цепочки, нити. Споры круглые 1,2 – 1,5 х 0,9 мкм.
Bacillus idosus — колоний сухие, матовые, плоские, мелкоморщинистые, полностью снимающиеся с поверхности агара. Клетки – узкие прямые палочки, 2 – 3 х 0,6 мкм, подвижные; споры круглые, пара толще материнских клеток, благодаря чего последние раздуваются при спорообразовании. Чаще споры образуются в центре клетки.
Bacillus agglomerates – колонии на МПА небольшие, белые, плоские, слизистые. Клетки палочковидные 3 – 6 х 0,4 – 0,5 мкм, одиночные и в парах, а время от времени соединены в маленькие палочки; подвижные (перитрихи).
Bacillus virgulus — колонии на агаризованных средах мелкозернистые либо волнистые с бахромчатыми краями. Микроб образует долгие нити с нередкими перегородками, распадающиеся на отельные клетки различной длины (4 – 10 х 0,7 – 0,8 мкм). Споры круглые, поперечник их белее поперечника клетки, исходя из этого при формировании спор клетки раздуваются, принимают веретенообразную либо булавидную форму. Условный анаэроб.
Bacillus brevis — образуют колонии белые, время от времени с желтоватым оттенком, ровные, выпуклые либо плоские блестящие с зубчатым краем, лучше развиваются на синтетических средах. Клетки размером 3 – 5 х 0,7 – 1 мкм, подвижные (перитрихи), реже соединены в цепочки. Споры круглые 0,8 – 1 мкм в поперечнике, расположены на финишах клеток, раздувают их оболочки. Бывают грамположительными и грамотрицательными.
Bacillus polymyxa – колонии бесцветные плоские либо вогнутые, ровные и слизистые, время от времени края колонии имеют пальчатые выросты, рост их на средах умеренный либо хороший. Клетки (2 – 7 х 1,0 –1,7 мкм) одиночные, парные либо в маленьких цепочках; подвижные. Споры круглые, продолговатые (2,6 х 1,7 мкм), находятся в центре. При спорообразовании клетки раздуваются клостридиально либо лимоновидно. Факультативный аэроб.
Bacillus asterosporus – образуют небольшие белые либо сероватые с зеленоватым отливом плоские, ласковые, слизистые гомогенные колонии. Клетки – толстые палочки (3 — 7 х 1,0 – 1,2 мкм), одиночные либо в парах. Подвижные, споры цилиндрические либо продолговатые (1,5 – 2,0 х 1,0 мкм), расположены в центре клеток. Последние при спорообразовании принимают клостридиальную форму.
Bacillus simplex – колонии ровные, жирно-блестящие, время от времени слизистые, выпуклые, рост хороший. В ветхих культурах отдельные штаммы покупают желтовато-бурую окраску. Клетки небольшие 2,5 – 0,6 мкм, в большинстве случаев одиночные, цепочки не обрезают. Споры круглые (0,9 х 0,6 мкм), расположены субтерминально. Жители различных земель.
Род Actinomycets – лучистые грибки. Образуют плотные кожистые колонии разной структуры (ровные, бугристые, складчатые, бородавчатые с мучнистым налетом). Колонии смогут быть различных оттенков, срастаются с субстратом и складываются из несептированных ветвящихся нитей.
Количественный учет микроорганизмов земли. Дабы установить количество клеток бактерий в 1 г. сырой земли, число колонии в чашке умножают на степень разведения, т.е. число, показывающее во какое количество раз в каждом конкретном случае разбавили 1 г земли. Наряду с этим в любых ситуациях, казалось бы, должно оказаться приблизительно однообразное число, но фактически это не совсем так. Время от времени клеток так много, что развившиеся колонии микроорганизмов сливаются – это довольно часто отмечается в чашках при разведении 10-2. При высоких разведениях вырастают единичные колонии меньше десяти, каковые смогут появиться от случайно попавших клеток из воздуха при внесении в чашку суспензии либо питательной среды. Учет таких чашек сделает подсчет недостоверным. Для верного определения численности клеток подсчитывают лишь такие чашки, в которых колонии более десяти и не более 250 – 300 (в последнем случае при условии, в случае, если колонии весьма небольшие). При подсчете колонии чашки просматривают в проходящем свете и, дабы два раза не подсчитывать одинаковые колонии, отмечают их фломастером по стеклу. Дабы не пропустить мелкоточечные колонии, чашки дополнительно просматривают под лупой.
Все результаты последующих пересчётов и подсчётов колоний записывают в таблицу 4.
Таблица 4 Определение количества микроорганизмов в земле
| № аудитории | Кол-во микроорганизмов в 1м3 воздуха | Степень загрязненности воздуха | Главная форма (%) |
Для качественной чёрта микрофлоры земли обрисовывают главные колонии по внешним показателям и их микроскопируют. форма и Методика записи такая же, как в таблицах 2 и 3.
Количественный и качественный учет микроорганизмов микрофлоры пищевых продуктов выполняют по методикам, обрисованным выше.
2 Контрольные вопросы
1) Что Вы осознаёте под термином «неспециализированное микробное число»?
2) Какие конкретно микробы относят к санитарно-показательным?
3) Каким требованиям должны подчиняться санитарно-показательные микробы?
4) Для каких целей применяют дифференциально-диагностические среды?
Лабораторная работа № 9
Молочнокислое брожение
1.1 Цель работы – познакомиться с возбудителями молочнокислого брожения и обучиться определять кислотность молока.
Задание
1. Выяснить кислотность свежего и скисшего молока.
2. Приготовить фиксированный препарат молочнокислых бактерий. Микроскопировать с иммерсией и зарисовать микробы.
Устройства, посуда, реактивы.
осветитель и Микроскоп; микробиологическая петля; предметные стекла обезжиренные; покровные стекла; стерильные пипетки на 1-2 мл; капельница с водой; хлопчатобумажная салфетка, фильтровальная бумага; спиртовка; бюретка для титрования , колбочки, красители (метиленовый светло синий), капельница с 96% спиртом, иммерсионное масло, дезинфицирующий раствор, 0,1 н NaOH, спиртовый раствор фенолфталеина, молоко (свежее и скисшее), спирт : эфир (1:1).
Молочнокислым брожением именуется процесс разложения углеводов молочнокислыми бактериями с образованием в основном молочной кислоты. По характеру брожения на данный момент различают две группы молочнокислых бактерий: гомоферментативные (однотипнобродящие) и гетероферментативные (разнотипнобродящие) бактерии. Гомоферентативные бактерии образуют молочную кислоту в качестве практически единственного продукта брожения углеводов с ничтожным содержанием побочных продуктов. Гетероферментативные молочнокислые бактерии образуют в любой момент наровне с молочной кислотой большие количества вторых продуктов. К примеру, уксусную и янтарную кислоты, этиловый спирт, водород и углекислый газ, ароматические вещества.
Движение работы Определение кислотности молока по Тернеру. Парное молоко содержит некое количество молочной кислоты, которая обусловливает начальную кислотность молока. Кислотность парного молока может колебаться от 10 до 25°Т. Исходя из этого перед постановкой опыта нужно установить исходную (начальную) кислотность молока, применяемого в качестве питательной среды.
Кислотность определяют способом титрования молока 0,1Н раствором NаОН при индикаторе фенолфталеине. Для титрования берут в колбочку 10 мл молока, разбавляют двойным количеством дистиллированной воды и прибавляют 2-3 капли 1%-ного спиртового раствора фенолфталеина. Смесь отлично перемешивают и титруют из бюретки 0,1 н. раствором едкого натра до появления розового окрашивания, не исчезающего в течение 2 мин. количество щелочи, отправившееся на нейтрализацию 10 мл молока, умножают на 10 (для расчета на 100 мл молока). Полученная величина показывает кислотность молока в градусах Тернера. Градусы Тернера показывают количество мл 0,1 н раствора NаОН, отправившегося на нейтрализацию кислотности 100 мл молока. 1°Т соответствует 9 мг молочной кислоты.
Определение конечной кислотности молока. Количество молочной кислоты, накопившейся в молоке, возможно выяснить по градусам Тернера. Для этого в колбу берут 1 мл скисшего молока, додают 20 мл дистиллированной воды и по ранее обрисованной методике определяют кислотность (конечную). Итог титрования умножают на 100. Из взятого числа вычитают исходную кислотность. Остаток будет показывать кислотность в градусах Тернера, появившуюся в следствии деятельности микроорганизмов. По данной кислотности возможно вычислить количество накопившейся молочной кислоты.
П р и м е р. Исходная кислотность 22°Т, а конечная — 180°Т. Тогда микробами накоплено 180 – 22 = 158°Т либо 158 • 9 = 1422 мг молочной кислоты на 100 мл молока..
Для изучения морфологии молочнокислых бактерий на чистое предметное стекло петлей наносят каплю молочной сыворотки либо прокисшего молока, смешивают ее с каплей стерильной воды и готовят мазок. Мазок высушивают, фиксируют спирт-эфиром либо в пламени горелки и обезжиривают легким прикосновением к тёплому мазку фильтровальной бумагой. Мазок окрашивают в течение З-5 мин метиленовым синим, промывают водой, высушивают, и исследуют с иммерсионной совокупностью.
2 Контрольные вопросы
1)Из каких этапов состоит процесс брожения?
2) Какие конкретно субстраты применяют молочнокислые бактерии?
3)Каков энергетический выход молочнокислого брожения?
4) Какие конкретно продукты образуются на протяжении гомо- и гетероферментативного молочнокислого брожений?
Лабораторная работа № 10