Для изучения поведения настоящего газа рассмотримизотермы Ван-дер-Ваальса — кривые зависимости р от Vm при заданных Т, определяемые уравнением Ван-дер-Ваальса для моля газа. Эти кривые (рассматриваются для четырех разных температур; рис. ) имеют достаточно необычный темперамент. При больших температурах (T Tк) изотерма настоящего газа отличается от изотермы совершенного газа лишь некоторым искажением ее формы, оставаясь монотонно спадающей кривой. При некоей температуре Tкна изотерме имеется только одна точка перегиба К.
Эта изотерма именуется критической, соответствующая ей температура Tк— критической температурой; точка перегиба К именуется критической точкой; в данной точке касательная к ней параллельна оси абсцисс. Соответствующие данной точке количество Vк, и давление рк именуются кроме этого критическими. Состояние с критическими параметрами (pк, Vк, Tк) именуется критическим состоянием. При низких температурах (Т Tк ) изотермы имеют волнообразный участок, сперва монотонно опускаясь вниз, после этого монотонно поднимаясь вверх и опять монотонно опускаясь.
Разглядывая разные участки изотермы при T
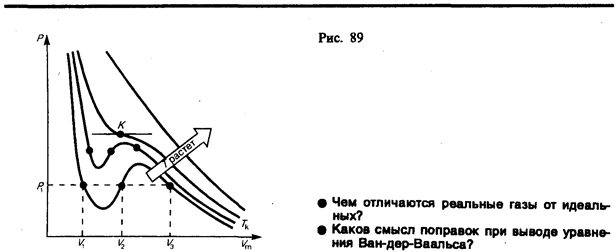
Рис. 102.
Эти выводы, следующие из анализа уравнения Ван-дер-направляться, были обоснованы опытами ирландского ученого Т. Эндрюса (1813—1885), изучавшего изотермическое сжатие углекислого газа. Отличие экспериментальных (Эндрюс) и теоретических (Ван-дер-Ваальс) изотерм содержится в том, что превращению газа в жидкость в первом случае соответствуют горизонтальные участки, а во втором — волнообразные.
В случае, если через крайние точки горизонтальных участков семейства изотерм совершить линию, то окажется колоколообразная кривая (рис. ), ограничивающая область двухфазных состояний вещества. критическая изотерма и Эта кривая дробят диаграмму р,Vm под изотермой на три области: под колоколообразной кривой находится область двухфазных состояний (насыщенный пар и жидкость), слева от нее находится область жидкого состояния, а справа — область пара. Пар отличается от остальных газообразных состояний тем, что при изотермическом сжатии претерпевает процесс сжижения. Газ же при температуре выше критической не может быть перевоплощён в жидкость ни при каком давлении.
Сравнивая изотерму Ван-дер-Ваальса с изотермой Эндрюса (верхняя кривая на рис. ), видим, что последняя имеет прямолинейный участок 2—6, соответствующий двухфазным состояниям вещества. Действительно, при некоторых условиях смогут быть реализованы состояния, изображаемые участками ван-дер-ваальсовой изотермы 5—6 и 2—3. Эти неустойчивые состояния называютсяметастабильными. Участок 2—3изображаетперегретую жидкость, 5—6 —пересыщенный пар. Обе фазы ограниченно устойчивы.
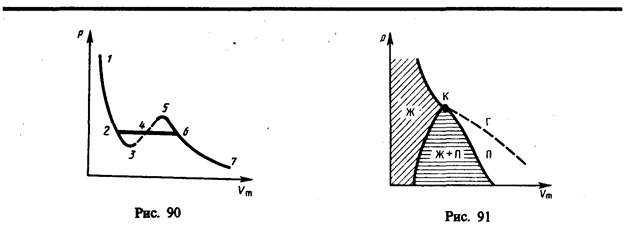
Рис. 103.
При низких температурах изотерма пересекает ось Vm, переходя в область отрицательных давлений (нижняя кривая на рис. ). Вещество под отрицательным давлением будет в состоянии растяжения. При некоторых условиях такие состояния кроме этого реализуются. Участок 8—9 на нижней изотерме соответствует перегретой жидкости, участок 9—10 — растянутой жидкости
При больших температурах(Т Тк) изотерма настоящего газа отличается от изотермы совершенного газа лишь некоторым искажением ее формы, оставаясь монотонно спадающей кривой.При температуре Тк на изотерме имеется только одна точка перегибаК.Данной температуре соответствуют: объемVk и давление pk.Состояние с параметрами (Vk, pk, Tk) именуется критическим. При низких температурах (Т Tk) изотермы имеют волнообразный участок, сперва монотонно опускающийся вниз, после этого монотонно поднимающийся вверх и опять опускающийся. Преобразуем уравнение Ван-Дер-Ваальса к виду
pVm3 — (RT + pb)Vm2 + aVm -ab = 0. (15.18.)
При заданныхзначенияхp и T,это уравнение третьей степени относительноVm; следовательно, оно может иметь или три вещественных корня, или один вещественный и два мнимых, физический суть имеют только вещественные хорошие корни. Первому случаю соответствуют изотермы при низких температурах (три значения количества газаV1, V2, V3 отвечают одному значению давленияр1), второму случаю — изотермы при больших температурах. Разглядывая разные участки изотермы при Т Tk , видим, что на участках 1 — 3 и 5 — 7 при уменьшении количества V давление pвозрастает, что конечно. На участке3 — 5 сжатие вещества ведет к уменьшению давления; опыт говорит, что такие состояния в природе не видятся. Наличие участка
3 — 5 свидетельствует, что при постепенном трансформации количества вещество не имеет возможности оставаться все время в виде однородной среды; в некий момент должно наступить распад вещества и скачкообразное изменение состояния на две фазы. Подлинная изотерма будет иметь вид ломаной линии 7 -6 -2 -1.Часть 7 — 6 отвечает газообразному состоянию, а часть2 — 1 — жидкому. В состояниях, соответствующих горизонтальному участку изотермы 6 — 2, отмечается равновесие жидкой и газообразной фаз вещества. Вещество в газообразном состоянии при температуре ниже критической именуется паром, а пар, находящийся в равновесии со своей жидкостью, именуется насыщенным. Пар отличается от остальных газообразных состояний тем, что при изотермическом сжатии преобразовывается в жидкость. Газ, же при температуре выше критической не может быть перевоплощён в жидкость ни при каком давлении.